二氮雜菲分光光度法測飲用水Fe2+時,緩沖溶液PH的計算
二氮雜菲分光光度法測飲用水Fe2+時,緩沖溶液PH的計算
秦梅
秦皇島市自來水總公司山海關公司 河北 郵編:066200
摘要:《二氮雜菲分光光度法測鐵中,緩沖溶液PH的計算》是根據我在工作中實際遇到的問題而寫的,從發現問題、分析問題、和解決問題的三部分對測鐵中緩沖溶液的PH的計算加以闡述,解決現在藥劑質量不穩定的情況下,如何使實驗中加入乙酸乙酸銨緩沖溶液后的PH保持在它的緩沖范圍3.76-5.76,使實驗順利進行這一問題,對于缺乏大型精密儀器實驗條件的基層,我覺得這個問題的解決很有必要。
關鍵詞:緩沖溶液、PH值、共軛酸堿、
1、概述:
鐵是水中最常見的一種雜質,含鐵量少的水對人體健康并無影響,但含鐵量太高的水易產生一些特殊氣味,飲用時很不可口。飲用水中的鐵的容許量為≤0.3mg/l,水中含鐵量在1mg/l左右,就易與空氣中的氧作用而產生渾濁現象。
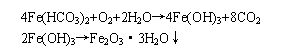
因此我們依據2001年9月1日起實施的《生活飲用水衛生規范》(以下簡稱《規范》)中的二氮雜菲分光光度法測定水中的鐵。
2、二氮雜菲分光光度法測鐵的原理
Fe2+與二氮雜菲在PH3-9的溶液中生成水溶性的橙紅色螯合物[(C12H8N2)3Fe]2+,該螯合物在水溶液中非常穩定,它的logKf=21.3,摩爾吸光系數ε510=1.1 × 104,其反應式如下:
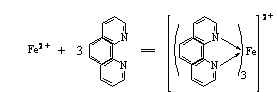
生成的紅色螯合物的最大吸收峰在510nm處。本方法選擇性很高,相當于含鐵量40倍的Sn2+、Al3+、Ca2+、Mg2+、Zn2+、SiO32-,20倍的Cr3+、Mn2+、V(Ⅴ) 、PO43-,5倍的Cu2+、Co2+等均不干擾測定。Fe3+也能與二氮雜菲反應生成淡藍色配合物,因此,在顯色前,首先用鹽酸羥胺把Fe3+離子還原為Fe2+離子,其反應式如下:
4Fe3+ + 2NH2OH·HCl → 2Fe2+ + N2↑ + 2H2O + 4H+ + 2Cl-
測定時,溶液pH值控制在5左右,酸度高時,反應進行較慢,酸度太低,則Fe2+離子水解,影響顯色。由此,我們不難看出做此項實驗時,溶液最后的pH值的大小對實驗的成敗起著至關重要的作用。
3、實驗中出現的問題
在二氮雜菲分光光度法測鐵的實驗操作中,常會出現當最后加完PH值=4.2的乙酸乙酸銨緩沖溶液(按照《規范》所規定方法配制)時,溶液中不出現橙紅色物質而是無色透明的,通過分析我們排除了其它因素,確定是乙酸乙酸銨緩沖溶液出現問題。我們用精密pH計測定其PH=3.38。我們用《規范》中的方法又重新配制一次發現還是PH=3.38,我們認為目前方法配制的乙酸乙酸銨緩沖溶液PH,在我們的實驗中已不能滿足要求,我們認為在藥劑質量不穩定的今天,這個問題有其普遍性,因此,我們應認真對待。
4、實驗中不同pH值緩沖溶液的確定
4.1公式的推導
在乙酸(HAc)乙酸銨(NH4Ac)緩沖溶液中:
平衡時,存在著較多的HAc 分子和Ac-,當外加酸時,外加的H+與Ac-結合成難電離的HAc分子,同時阻止HAc進一步電離,故不會使溶液中的[H+]急劇增大,從而使PH保持不變。如果外加少量堿,則由強堿電離出來的OH-就會與HAc電離出來的H+結合成H2O,這時[H+]下降,平衡向著電離方向移動來補充H+,從而保持PH基本不變。 在HAc——Ac-緩沖體系中,依據(1)、(2)式 它的電離平衡常數 Ka =[H+][Ac-]/[ HAc] [H+]= Ka[ HAc]/ [Ac-] 等式兩邊取負對數-lg[H+]=-lgKa+{-lg[ HAc]/ [Ac-]} 即PH=PKa+lg{ [Ac-]/[ HAc]} 其中 PKa=4.76 ……(3) 從(3)式可以看出:該緩沖溶液的PH主要決定于PKa,同時與其共軛酸堿的濃度比[Ac-]/[ HAc]有關,對于同種緩沖液PKa一定,PH隨[Ac-]/[ HAc]而變化,當溫度一定時,溶液PH不因稀釋而產生明顯的變化,具有一定的抗稀釋作用。緩沖溶液的緩沖能力是有限的,而不是無限,的。當其抗酸抗堿成分用盡時,就無緩沖能力了,足夠濃度的共軛酸共軛堿組成的緩沖溶液,其PH變化范圍大致相當于PKa±1,約2個單位范圍,才能發揮滿意的緩沖作用。由此看出,乙酸(HAc)乙酸銨(NH4Ac)緩沖體系的PH有效緩沖范圍是:3.76-5.76,加入緩沖溶液后的待測樣的PH只要達到這個范圍,哪怕只是剛剛進入這個范圍如:達到3.78,都會出現變色,并且增加緩沖溶液的體積對顯色速度不起作用。依據以上理論,我們通過計算結合試驗來配制適合pH值的HAc——Ac-緩沖溶液,以抵消藥劑質量的影響,使pH值能夠滿足3.76-5.76這一范圍。 ∵在HAc——Ac-緩沖體系中PH= 4.76+lg{[Ac-]/[ HAc]} ∴ 4.2= 4.76+lg{[Ac-]/[ HAc]} Lg{[Ac-]/[ HAc]}=-0.56 [Ac-]/[ HAc]=0.27 ∵在此緩沖體系中Ac-主要來自NH4Ac的電離, ∴[Ac-]=[ NH4Ac] ∴[Ac-]/[ HAc]= [ NH4Ac] /[ HAc]= 0.27 又∵HAc、NH4Ac處于同一體系, ∴[ NH4Ac] /[ HAc]= NH4Ac的摩爾數/ HAc的摩爾數 ∵NH4Ac的分子量是77 ,實驗用冰乙酸HAc的摩爾濃度是17mol/l ∴如果取乙酸銨250克溶于少量純水,需要加多少毫升冰乙酸混勻才能成為PH=4.2緩沖溶液呢? [Ac-]/[ HAc]= [ NH4Ac] /[ HAc]=(250/77)/(17×V)=0.27 V=0.7L=700mL 即取乙酸銨250克溶于少量純水,需要加700毫升冰乙酸混勻才能成為PH=4.2的緩沖溶液。 同理,我們可以根據此種方法計算出其它適合自己需要的PH緩沖溶液。當然,配制不同PH的乙酸乙酸銨緩沖溶液時,它的PH必須在3.76-5.76這個范圍,大于或者小于這個范圍,其緩沖比[Ac-]/[ HAc]〉10或〈0.1,緩沖容量小于0.01,不具有緩沖能力。 5、結束: 在基層化驗室沒有較精確的大型檢測設備,可見光分光光度計就屬于很精密的儀器了,在這種條件下,我們只有憑著精益求精的態度做好化驗工作,雖然基層的化驗員會更辛苦,但我們會以更加認真、更加務實的態度做好最基層的化驗工作。以上是我把二氮雜菲分光光度法測鐵中,緩沖溶液PH計算方法呈現給大家,如有紕漏歡迎各位同行的指正。 姓名秦梅年齡33歲,1996年畢業于河北建筑工程學院給排水專業本科學士學位,現工作于秦皇島市自來水總公司山海關公司水質科,職務是水質科長,職稱是給排水工程師。 通訊地址:秦皇島市山海關自來水公司水質科 秦梅
4.2乙酸(HAc)乙酸銨(NH4Ac)緩沖溶液pH計算
我們以《規范》中所配制的pH=4.2的乙酸(HAc)乙酸銨(NH4Ac)緩沖溶液為例計算。
為方便大家,下表為采用以上方法計算出其它PH的緩沖溶液的乙酸銨和乙酸的理論用量,在實驗中要進一步測量配制溶液的PH:
郵編:066200
電話:0335-5027069(單位)
電子信箱:liwei3162316@163.com
論文搜索
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








