氯代有機物脫氯時pH值變化影響因素的研究
吳德禮,馬魯銘,王錚,徐文英
(同濟大學環境科學與工程學院城市污染控制國家工程研究中心,上海 200092)
摘要:研究了氯代有機物在Fe/Cu雙金屬體系中發生還原脫氯反應時pH值的變化與影響因素,結果表明在脫氯過程中pH值會不斷發生變化,pH值條件對還原脫氯有很重要的影響,其最佳初始pH值條件為4-5左右,但是該反應體系有較強的pH值緩沖功能,能夠適應較廣的pH值變化范圍。
關鍵詞:氯代有機物;催化還原;還原脫氯;pH值變化
中圖分類號:X703.1 文獻標識碼:A 文章編號:1009—2455(2004)05—0043—04
A Study of Factors Affecting VariaUon of pH Values during Dechlorination of Chloroorganics
wu De-li,MA Lu-ming,WANG Zheng,XU Wen-ying
(The State Engineering Research Center for Municipal Pollution Control under the College of Environmental Science and Engineering, Tongji University,Shanghai 200092,China)
Abstract: A study was made on the variation of pH values in the reductive dechlorination of chloroorganics in a Fe/Cu bimetal system as well as the affecting factors.The results show that the pH values keep changing during dechlorination,the conditions of pH vahles have a very important influence on reductive dechlorination,the optimum initial pH value is around 4—5,while the said reaction system has a strong pH value buffering function and is adaptable to a wide range of variation of pH values.
Key words:chloroorganics;catalytic reduction;reductive dechlorination;variation of pH values
氯代有機物的污染一直是非常重要的環境問題,得到各國的廣泛關注。利用零價金屬(如鐵、鋁、鋅等)還原脫氯處理氯代有機物是最近幾年發展起來的新技術[1-2],由于單質鐵價廉易得,而且不會產生二次污染,所以得到了廣泛的應用,被認為是應用前景廣闊的污染物治理技術[3-5]。
目前的研究主要集中在利用金屬鐵粉來修復受氯代有機物比如PCE,TCE等[6-7]污染的地下水方面。為改善脫氯效率,也有研究通過加入鈀、鎳等貴金屬做為催化劑來加速氯代有機物的還原脫氯速率和提高脫氯程度[8-9]。關于反應的機理和動力學問題目前還存在著很多爭論,其中pH值的變化和影響在目前的研究中就還沒有定論[10],由于在氯代有機物的還原脫氯過程中有H+的參與,所以pH值會在反應過程中起到非常重要的作用,而且隨著反應的進行溶液的pH值可能會發生變化,所以本文重點討論氯代有機物在Fe/Cu雙金屬體系中發生還原脫氯時pH值的變化以及影響因素的研究。這對于推動金屬還原技術的實際應用是非常重要的。
1 實驗方法
在實驗中使用的是鐵刨花和銅刨花組成的混合雙金屬系統,銅的加入能促進鐵的腐蝕氧化,加速鐵與氯代有機物反應的進行。將從機械加工廠取來的鐵刨花和銅刨花進行除油清洗處理以后,用高純水清洗,用硝酸汞滴定法檢測氯離子直至清洗液中無氯離子為止,然后將其烘干。稱取一定量的烘干后的鐵刨花和銅刨花(兩者按一定的比例稱取),將其混合均勻后裝入實驗瓶中并將其壓實,堆積密度約為0.5 kg/L。
受試溶液分別用四氯化碳和1,1,2,2—四氯乙烷與蒸餾水配制而成,pH值使用硫酸或氫氧化鈉調節。溶液配置好以后將其加入實驗瓶中,然后用包有聚四氟乙烯膜的橡皮塞將瓶口塞緊,放人搖瓶柜中以恒定速度搖動,溫度控制在25℃。定期取樣分析溶液中的氯離子濃度和pH值的變化以及通過GC/MS檢測反應產物。
2 實驗結果
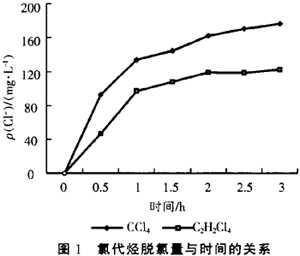
在pH值中性初始條件下,實驗了四氯化碳(CCl4)和1,1,2,2—四氯乙烷(C2H2C14)溶液的還原脫氯研究,配制的CCl4溶液和C2H2C14溶液的質量濃度分別為217mg/L和222mg/L。其還原脫氯反應過程中脫氯量與反應時間的關系如圖1所示。從圖1中可以看出,溶液中Cl-濃度增加得很快,經使用Finnigan Voyager氣相色譜—質譜聯用儀(GC/MS)檢測,其中CCl4的主要脫氯中間產物為CHCl,和CH2Cl2,而1,1,2,2—四氯乙烷的主要脫氯中間產物為1,2—二氯乙烯。所以通過金屬單質鐵的還原作用和銅的催化作用,可以有效的使氯代烴發生還原脫氯反應。
3 pH值對脫氯反應的影響
鐵、銅雙金屬體系對氯代有機物的還原脫氯反應受pH值變化的影響如圖2所示,圖2中實驗以CCl4溶液的還原脫氯反應為例,CCl4的初始質量濃度均為200ms/L,反應時間為1 h,溶液初始pH值分別用硫酸和氫氧化鈉調節。
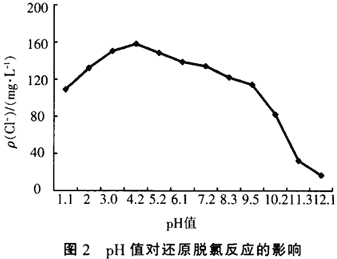
從圖2中可以看出,pH值對還原脫氯反應影響很大,pH值過高或過低都會減慢脫氯反應,尤其是在pH值大于10以后,脫氯速率直線下降,效果非常差。其原因是在該體系中還原脫氯主要是發生如下反應:
Fe0+RClx+H++Fe2++RHC]x-1+Cl-
在該反應中要消耗H’,而在強堿性環境中H+濃度非常低,并且由于反應:Fe0+2H2O→Fe(OH)2+2H+而生成的H+也會立即與OH-結合成水,同時由于水中存在溶解氧,在堿性環境中容易發生反應:O2+2H2O+4e+4OH-,所以鐵釋放的電子很容易被0:得到,所以在高pH值條件下,還原脫氯反應很難進行。在強酸性環境中,由于存在過多的H+,結果會優先發生析氫反應,即H+與氯代有機物爭奪Fe0氧化所釋放的電子,而發生如下反應:2H++2e→H2,所以也會影響氯代有機物的還原脫氯反應。從實驗中看出溶液pH值在4-5之間是最有利于發生還原脫氯反應的,但是也可以看出該體系適應pH值范圍很廣,pH值在2—9之間都有不錯的還原脫氯效果,在此范圍內pH值影響不是特別大。
4 反應過程中pH值的變化
4.1 中性初始條件下oH值的變化
實驗中發現,在氯代有機物的還原脫氯處理過程中,溶液的pH值是不斷變化的。在初始pH值為中性條件時,含氯有機物的溶液經處理后,pH值都有不同程度的降低,一般最后能降到5左右,而且處理效果越好,pH值降得越低。圖3是在處理CCl4溶液過程中pH值隨脫氯過程的變化,溶液初始pH值為7.2。
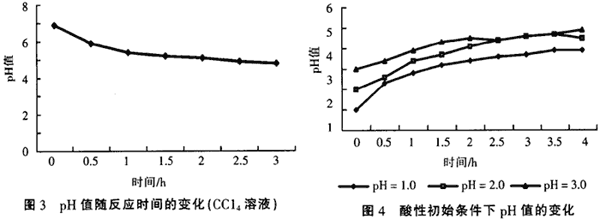
氯代有機物在鐵、銅體系中發生的還原脫氯反應可用下面的方程來表示(初始為中性條件下),
Fe0+2H2O+Fe(OH)2+2H++2e
RClx+H++2e→RHClx-1+Cl-
總的方程式為
Fe+2H2O+RClx→Fe(OH)2↓+RHClx-1+HCl
所以當1 mol的RClx發生還原脫氯以后,就會產生1 mol的HCl,pH值自然會降低,這是在假定Fe2+完全沉淀的情況下,但在當時的pH值條件下,Fe2+沉淀不完全,而且隨著pH值的降低,又會有部分Fe(OH)2沉淀溶解,消耗部分H+,對pH值起到緩沖作用,所以H+的產生量并非與RClx的還原量呈嚴格正比關系,同時pH值也不會降到很低,一般在5.0左右,如果pH值降到很低,就不會產生Fe(OH)2沉淀,如果反應不產生Fe(OH)2沉淀則會發生如下反應:
Fe+H++RClx→Fe2++RHClx-1+Cl-
所以在反應過程中會消耗H+,導致pH值回升,而且在以前產生的Fe(OH)2沉淀這時也會與H+反應而溶解,因此pH值就不會繼續降低,該體系對pH值有緩沖調節作用。
4.2 酸性初始條件下pH值的變化
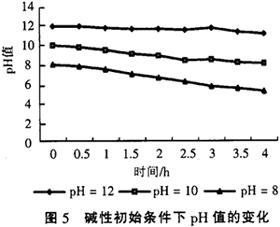
中性初始條件下,隨著反應的進行溶液pH值不斷下降,而在酸性初始條件下,隨著反應的進行pH值卻在不斷上升,但是在最后只是上升到pH值為5.0左右。該實驗仍以四氯化碳溶液的還原脫氯處理為例,配制了3種不同pH值條件的四氯化碳溶液,但初始都是在酸性條件下,CCl4溶液的初始質量濃度為200mg/L,pH值分別為1.0,2.0和3,0,3種溶液還原脫氯處理過程中pH值的變化如圖4所示。
從圖4可以看出,在酸性初始條件,隨著還原脫氯反應的進行,溶液pH值開始升高,而且一開始升高的較快,到2h后變得非常緩慢,最后基本都穩定在4.5左右。因為在酸性條件下主要是發生了如下反應:Fe+2H+→Fe2++H2
Fe+RCl+H+→Fe2++RH+Cl-
所以會大量消耗溶液中的H+,致使溶液pH值開始升高,在反應剛開始時,H+充足,所以會迅速發生析氫反應,pH值變化很快,隨著反應的進行,H+濃度越來越少,析氫反應也就越來越弱,主要發生還原脫氯反應了,所以pH值變化較為緩慢。因此鐵銅反應體系具有良好的pH值調節緩沖功能,如果時間允許,該體系可以自動調節pH值,等消耗一定量的鐵后,pH值就會調節到一定范圍,使一開始較為緩慢的還原脫氯反應開始加速,所以該方法能耐pH值變化沖擊,在較寬的pH值變化范圍內都有很好的還原脫氯效果。
4.3 堿性初始條件下pH值的變化
該反應體系不但能調節緩沖酸性pH值條件,也能夠承受一定的堿性pH值變化。在初始條件為堿性時,隨著反應的進行pH值也會逐漸降低,但是此條件下調節能力不強,經過一段時間后,pH值仍在7以上。仍以四氯化碳溶液為例,配制了3種不同pH值條件的四氯化碳溶液,CCl4溶液的初始的質量濃度為200mg/L,pH值分別為8,10和12,3種溶液還原脫氯處理過程中pH值的變化情況如圖5所示。
從圖5可以看出,鐵、銅雙金屬體系在還原脫氯處理氯代有機物時對強堿性,高pH值溶液的緩沖適應能力不是很強,尤其是在pH值大于10以上,從圖5看出,初始pH值為12的CCl4溶液在反應過程中pH值基本沒有什么變化,而實驗證明該條件下還原脫氯效果也是非常差的,而對于初始pH值為8的CCl4溶液,在整個反應過程中pH值下降了很多,最后經過4個小時后pH值能達到5.5左右,而脫氯實驗也證明在初始pH值為8時仍有很好的還原脫氯效果。
在強堿性溶液中(pH值大于10以上),蝕氧化的很慢,而且主要是發生了吸氧腐蝕:2Fe0+2H2O+O2→2Fe(OH)2↓
由于H+濃度非常低,而OH—濃度非常高以下面反應是非常有限的:Fe0+2H2O→Fe(OH)2+2H++2e
Fe+RClx+H+→Fe2++RHClx-1+Cl-
所以在此條件下還原脫氯反應難以發生,脫氯效果不好,而且溶液pH值的緩沖調節功能不強。而對pH值為8的初始條件,由于溶液中堿性不是特別強,所以仍有很大的可能發生還原脫氯反應,而且在此條件下鐵氧化產生的Fe2+幾乎都轉變為了Fe(OH)2沉淀,所以隨著反應的進行,在脫氯過程中就會產生很多H’,這樣很快就中和了溶液中過多的OH-,使溶液pH值不斷下降,pH值下降也進一步促進了還原脫氯反應的進行,所以最終pH值還可以降到6以下,而且仍舊有很好的還原脫氯效果。所以該反應體系對堿性環境也有很好的緩沖調節功能,但是如果在強堿性(pH>10)的初始條件下,體系將失去部分pH值調節功能,不能達到非常理想的還原脫氯效果。
5 結語
在氯代有機物的還原脫氯反應過程中,pH值有著重要的影響,在該實驗中最佳的初始pH值條件為4-5左右,但是由于該反應體系有著很好的pH值緩沖調節功能,在反應過程中pH值會有不同的變化,所以該體系可以適應較廣的初始pH值條件,在初始pH值從2.0到9.0的范圍內都有很好的還原脫氯效果。但是該反應體系不能適應強堿性環境,所以在實際應用中要考慮廢水pH值的的影響和變化,如果pH值大于10以上,要考慮調節溶液的pH值。
參考文獻:
[1] J Morales,R Hutcheson.Dechloriantion of chlorinated phenols by catalyzed and uncatalyzed Fe(0)and Mg(0)Prticles[J].Joumal of Hazardous Materials,2002,B90:97—108.
[2] Tatiana N B,LagadicI,Gleb B Sergeev,et al.Activated and nonactivated forms of zinc powder: reactivity toward chloroearbon in water and AFM Studies of surface morphologies[J].Environ Sci Technol,1998,32(17):2614—2622.
[3] Andrews E J, Novak P J.Influence of ferrous and pH oncarbon tetrachlohde degradation by methanosarcina thermophila[J].water research,2001,35(9):2307—2313.
[4] Deng B,Burris D R,Campbell T.Reduction of vinyl chlorinated in metallic iron-water system[J].Environ Sci&Technol,1999,33(15):2651—2655.
[5] Hozalski R M,Zhang L,Arnold W A.Reduction of haloacetic acids by FeO:implications for treatment and Fate[J].Environ Sci Technol,2001,35(11):2258—2263.
[6] Ruiz N,Seal S,Reinhart D.Surface chemical reactivity in selected zero—valent iron samples used in groundwater remediation [J].ournal of Hazardous Materials,2000,B80:107—117.
[7] slater G F.Isotopic fractionation during reductive dechlorination of trichloroethene by zero—valent iron:influence of surface treatment[J]. chemosphere,2002,49(4):589—596.
[8] Tsyganok A I,Otsuka K.Selective dechlorination of chlorianted
phenoxy herbicides in aqueous medium by electrocatalytic reduetion over palladium—loaded carbon felt[J].Applied Catalysis B:Environmental,1999,22(1):12—26.
[9] Clark Ⅱ C J,Rao P S C,Annable M D.Degradation of perchloroethylene in cosolvent solutions by zero-valent iron [J].Journal of Hazardous materials,2003,B96:65—78.
[10] Chen J L,AI—Abed S R,Ryan J A,et al.Effects of pH on dechlohnation of trichloroethylene by zero—valent iron [J].Journal of Hazardous Materials,2001,B83:243—254.
作者簡介:吳德禮(1977—),男,山東濰坊人,博士生,電話(021)65986832,65982106,wdli101@163.com。
論文搜索
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








