臭氧氧化降解苯酚的動力學研究
鐘理,陳建軍,張浩
(華南理工大學化工學院, 廣東廣州 510640)
摘 要:用雙混型光譜儀反應器研究了苯酚在溫度為288~313K、pH=3.2~9.3時的臭氧(O3)氧化反應動力學并獲得了反應動力學常數,探討了O3氧化降解苯酚的機理,即不同pH值時O3氧化降解苯酚的途徑及其動力學是不同的,在酸性及弱酸性條件下(pH=3.2~6.5)苯酚的降解遵循O3直接氧化機制,在堿性時(pH=9.3)則遵循羥基自由基氧化機制。
關鍵詞:苯酚;O3;反應動力學; pH值
中圖分類號:X131
文獻標識碼:A
文章編號:1000-4602(2002)09-0008-04
Study on the Kinetics of Phenol Degradation by Ozonization
ZHONG Li, CHEN Jian?jun, ZHANG Hao
(School of Chemical Engineering,South China University of Technology,Guangzhou?510640,China)
Abstract:The reaction kinetics of phenol ozone oxidation was investigated at temperature of 288~313 K and pH value of 3.2~9.3 by using a reactor with the Stopped-Flow Spectrometer,and the kinetic constant was obtained.Phenol degradation mechanism by ozonization was also discussed.The result showed that at varied pH value,ozonization for phenol degradation has different approaches and kinetics.In acid or weak acid ( pH=3.2~6.5) solution,direct ozonization predominates over phenol degradation;while in alkaline (pH=9.3) solution,oxidation of hydroxyl radicals is dominant.?
Keywords: phenol; ozone; reaction kinetics; pH value
石油、化工、制漿造紙、塑料、印染工業等[1、2]都會產生含苯酚及其同系物的廢水,這類廢水通常較難進行生物處理,且苯酚類化合物會在水體中積累、遷移,危害極大。由于苯酚可作為苯酚類同系物的參照對比物,故通過研究苯酚的O3氧化降解過程、分析苯酚和O3的分子結構來探討苯酚的O3氧化降解機制對苯酚及其同系物的廢水處理有一定的指導作用。?
1 試驗裝置及方法
試驗儀器、設備主要有:
① PHs-25型酸度計
帶有一個玻璃球敏感電極,可測pH值范圍為0~14,測量誤差為±0.1。
② JB-2型恒溫磁力攪拌器
③ BX-6型臭氧發生器
④ 雙混型光譜儀反應器
該反應器可使不同的液相反應物在0.001s內混合均勻,之后可通過測定水中溶解反應物(O3或苯酚)對UV的吸收率隨時間的變化并利用Beer-Lamer定律轉變為濃度隨時間的變化來研究其反應動力學。
試驗用O3是由純氧通過臭氧發生器制備的。根據試驗要求,將含O3的氣體通入水中5~25min制取所需濃度的O3溶液。苯酚為分析純,先用蒸餾水稀釋,然后用硫酸和氫氧化鈉將溶液的pH值調節到一定的值(之所以沒有像其他研究者那樣采用磷酸鹽緩沖溶液控制pH值是為了盡量避免磷酸鹽對羥基自由基的清除作用[2])。
2 結果與討論
2.1 UV 波長選擇
在試驗濃度范圍內O3和苯酚的吸收率隨UV波長(200~380nm)的變化如表1所示。
從表1看出,O3在260nm處存在最大吸收率,而苯酚分子及苯酚離子的最大吸收率發生在270、290nm波長以下。分別在酸性、弱酸性、堿性條件下進行了試驗,對波長的選擇則從以下方面考慮:若苯酚過量而以O3作為有限反應物,則可忽略苯酚在反應過程中的變化,因此在某一波長下測得反應物吸收率隨時間的變化實際上是反映了O3的衰減,故以O3的最大吸收波長(260nm)作為試驗波長。
2.2 苯酚與O3的反應濃度比
圖1是反應初始pH值為3.0時苯酚與O3的反應濃度比。
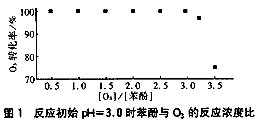
通過測定O3氧化過程中O3的轉化率來確定苯酚與O3的反應濃度比。讓一定量的苯酚與已知量的O3混合反應,當O3過量時可通過碘化鉀法測定O3的過剩量。
從圖1可見,完全破壞1mol苯酚至少要消耗3mol的O3,故反應濃度比約為3,與其他pH值時的結果類似,故反應濃度比取3。
2.3 苯酚的O3氧化動力學
苯酚的O3氧化降解試驗在溫度為288~313K、pH=3.2~9.3條件下進行,初始O3濃度為1×10-4mol/L,苯酚與O3的初始濃度比為1.25~10。圖2是溫度為313K、pH=3.2時相對于O3的反應級數確定結果。
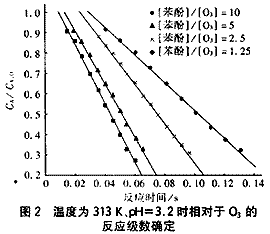
從圖2可見,無因次O3濃度CA/CA,0與反應時間的關系為一直線,表明苯酚的O3氧化反應在酸性條件時相對于O3濃度是零級反應。直線的斜率為表觀速率常數k′[6.8~14.6 L/(mol·s)],其值在一個數量級內變化。
從不同pH值條件下O3與苯酚的反應相對于O3的反應級數確定的試驗中可觀察到,在弱酸性(pH=4.0)、接近中性(pH=6.2)及堿性(pH=9.3)時,相對于O3濃度的反應級數均為一級。
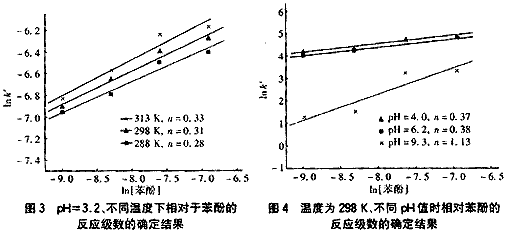
圖3是在不同溫度時相對于苯酚的反應級數的確定結果。由圖3可見,不同溫度時苯酚在反應中的級數幾乎不變,通過回歸分析得到相對于苯酚濃度的反應級數為0.3。
圖4是溫度為298K、不同pH值條件下苯酚的O3氧化降解反應相對于苯酚的反應級數的確定結果。
從圖4可知,在酸性或接近中性條件時相對于苯酚的反應級數在0.4左右,但在堿性條件(pH=9.3)時相對于苯酚的反應級數約為一級。可見,在堿性條件時苯酚濃度對反應的影響明顯增大。
圖5是在pH=3.2時苯酚的O3氧化反應速率常數k與溫度T的關系。
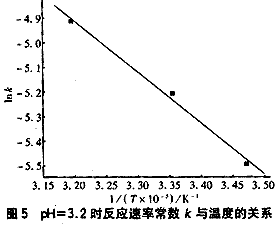
從圖5看出,隨溫度升高,反應速率明顯增大,符合一般化學反應規律。在pH=3.2時回歸的Arrhenius方程為:?
k=5.163exp(-1710/RT)?
3 氧化機理探討
O3與水中有機物的反應十分復雜,可分為O3分子對溶解有機物的直接攻擊和臭氧分解產生的羥基自由基與有機物的間接反應。兩種反應的程度取決于有機物的性質及其分子結構和反應條件。
苯酚分子的活化過程作用機理較復雜且是一個慢步驟,活化苯酚分子只占總苯酚分子數的一部分,因此在酸性(pH=3.2)條件下苯酚主要以分子形式存在。O3氧化降解苯酚的機理為活化的苯酚分子與O3分子的直接氧化,而苯酚分子的活化過程是降解反應中的控制步驟,所以其O3氧化動力學速率與O3濃度無關而與苯酚濃度有關,但不成正比關系,這一點與前面的試驗結果是一致的。
由于羥基的供電子作用而使被活化的苯酚分子鄰位和對位在某一瞬間有足夠的負電荷,這有利于O3分子的親電攻擊。苯酚分子的間位則直接被O3分子氧化,Eisenhauer證實了鄰苯二酚將繼續被O3分子氧化形成下級中間產物(鄰苯醌),并提出了相似的機理解釋鄰苯醌的產生。
O3分子對苯酚分子對位的攻擊過程也與上面的降解途徑相似,空間結構決定了O3分子攻擊對位生成中間產物(對苯二酚)比生成鄰苯二酚難得多,Li在研究中觀察到中間產物鄰苯二酚的量比對苯二酚的量要多數倍也證明了這一點。
在較高的pH值條件下苯酚分子中的氫原子極易以質子的形式離去而生成苯氧負離子,其共振式經過活化后同樣會使苯環的鄰、對位有足夠的負電荷而有利于O3分子的親電進攻。活化后的苯酚離子的O3氧化降解過程與活化的苯酚分子相似,機理為:
![]()
當pH值升高到堿性,產生的羥基自由基量明顯增多(羥基自由基和苯環反應生成酚氧自由基)。苯酚在堿性和氧化劑作用下形成的酚氧自由基能發生鄰-對、鄰-鄰及對-對偶聯,說明在苯環的鄰、對位上具有活性自由基,使得苯酚更易與羥基自由基反應。
許多研究者報道了苯酚的降解途徑,Singer在半間歇反應器和用高效液相色譜研究了苯酚在pH=3.0、6.0、8.9時的反應中間產物及最終產物;Li在pH=1.5~5.2、O3過量的間歇反應器中研究了苯酚O3化過程,通過對中間產物與最終產物的分析證明了上述的機理。
4 結論
O3氧化降解苯酚的機理及反應動力學隨著反應體系的pH值不同而不同。當pH=3.2時總反應級數為0.3,相對于苯酚濃度的反應級數為0.3,與O3濃度無關;當pH=4.0和6.2時總反應級數為1.35,相對于O3和苯酚濃度的反應級數分別為1和0.35;當pH=9.3時總反應級數約為2,相對于O3和苯酚濃度的反應級數均為1級,經回歸分析得pH=3.2時反應動力學常數與溫度的關系為:k=5.163exp(-1710/RT)。
參考文獻:
[1] 鐘理,KuoCH.含氯酚廢水O3/H2O2高級氧化過程及其動力學[J].中國造紙,2000,19(3):35-38.
[2] 鐘理,KuoCH,Zappi ME.三氯乙烯液相O3氧化實驗研究[J].化工學報,1998,49(1):116-119.
作者簡介:鐘理(1956-),男,湖北長陽人,華南理工大學教授,博士,主要從事化學工藝及水處理方面的研究。
電 話:(020)87111517(H)
收稿日期:2002-02-22
論文搜索
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








