化學(xué)反硝化法脫除地下水中的硝酸鹽
| 論文類(lèi)型 | 技術(shù)與工程 | 發(fā)表日期 | 2001-11-01 |
| 來(lái)源 | 《中國(guó)給水排水》2001年第11期 | ||
| 作者 | 范彬,黃霞 | ||
| 關(guān)鍵詞 | 地下水 硝酸鹽 化學(xué)反硝化 催化反硝化 | ||
| 摘要 | 范彬,黃霞 (清華大學(xué)環(huán)境科學(xué)與工程系,北京100084) 摘 要:綜述了地下水中的硝酸鹽采用化學(xué)反硝化方法進(jìn)行處理的最新研究進(jìn)展。與生物反硝化法相比,化學(xué)反硝化法具有潛在的經(jīng)濟(jì)優(yōu)勢(shì)和對(duì)小型及分散給水處理的適應(yīng)性。以鐵為代表的活潑金屬還原法的特點(diǎn)是還原劑價(jià)格低廉、來(lái)源廣泛,但反硝化的產(chǎn)物主要 ... | ||
范彬,黃霞
(清華大學(xué)環(huán)境科學(xué)與工程系,北京100084)
摘 要:綜述了地下水中的硝酸鹽采用化學(xué)反硝化方法進(jìn)行處理的最新研究進(jìn)展。與生物反硝化法相比,化學(xué)反硝化法具有潛在的經(jīng)濟(jì)優(yōu)勢(shì)和對(duì)小型及分散給水處理的適應(yīng)性。以鐵為代表的活潑金屬還原法的特點(diǎn)是還原劑價(jià)格低廉、來(lái)源廣泛,但反硝化的產(chǎn)物主要是氨氮。化學(xué)催化反硝化方法被認(rèn)為是最有應(yīng)用前景的脫除地下水中硝酸鹽的方法,但受反應(yīng)過(guò)程中傳質(zhì)因素的限制,目前在催化活性和選擇性方面還不夠理想。
關(guān)鍵詞:地下水;硝酸鹽;化學(xué)反硝化;催化反硝化
中圖分類(lèi)號(hào):TU991.11+2
文獻(xiàn)標(biāo)識(shí)碼:B
文章編號(hào):1000-4602(2001)11-0027-05
人類(lèi)大規(guī)模的固氮活動(dòng)(如工業(yè)固氮和大規(guī)模生物固氮)破壞了自然界氮素循環(huán)的平衡,很久以來(lái)地球上每年的固氮量遠(yuǎn)遠(yuǎn)超過(guò)通過(guò)反硝化釋放的氮素量,從而導(dǎo)致硝酸鹽氮在地下水中的積累,并日趨嚴(yán)重。攝入過(guò)多的硝酸鹽對(duì)人的健康有多方面的危害,如引起高鐵血蛋白癥及誘發(fā)癌癥等,對(duì)牲畜也有多方面的危害。世界衛(wèi)生組織早就規(guī)定飲用水中的硝酸鹽氮<10mg/L,而我國(guó)的標(biāo)準(zhǔn)仍為20mg/L。
脫除地下水中硝酸鹽污染的方法有多種,目前已經(jīng)投入實(shí)際應(yīng)用的主要是生物反硝化、離子交換及反滲透工藝[1]。盡管一些物化方法可以將硝酸鹽從飲用水中分離出來(lái),但解決地下水中硝酸鹽污染的根本出路還是要恢復(fù)自然界氮素循環(huán)的平衡:①限制人工固氮并倡導(dǎo)清潔的農(nóng)業(yè)生產(chǎn);②采取人工方式促進(jìn)氮素以氮?dú)庑问结尫湃氪髿狻⑺邢跛猁}氮還原為氮?dú)獾姆椒梢苑譃閮纱箢?lèi):生物反硝化和化學(xué)反硝化。生物反硝化法早在20世紀(jì)80年代初就已實(shí)際應(yīng)用,但仍存在一些缺點(diǎn):①工藝復(fù)雜、運(yùn)行管理要求高;②給被處理水造成各種不同程度的二次污染,一般需要后續(xù)處理;③反硝化速度慢、所需反應(yīng)器體積龐大、建設(shè)費(fèi)用高;④不太適合用于小規(guī)模及分散給水處理。與生物反硝化相比,化學(xué)反硝化法有兩個(gè)潛在的突出優(yōu)點(diǎn):①單位體積反應(yīng)器的脫硝速度可以比生物反硝化法快得多;②工藝簡(jiǎn)單,對(duì)運(yùn)行管理的要求低。
1 化學(xué)反硝化法
就化學(xué)還原法而言,無(wú)論采取何種還原劑(能)或還原方式,基本上可以肯定硝酸鹽氮首先被還原為亞硝酸鹽氮,繼而被還原為氮?dú)饣虬钡膩喯跛猁}氮繼續(xù)還原可能要經(jīng)過(guò)NO或N2O階段,但目前對(duì)硝酸鹽氮的還原反應(yīng)歷程缺乏一致的認(rèn)識(shí)。
迄今為止對(duì)化學(xué)反硝化法脫除飲用水中硝酸鹽氮所進(jìn)行的研究?jī)H局限于采用氫氣、活潑金屬以及甲酸、甲醇等數(shù)種還原劑。現(xiàn)將其分為活潑金屬還原法與催化反硝化法兩大類(lèi)。前者是以鐵、鋁、鋅等金屬單質(zhì)為還原劑,后者指以氫氣以及甲酸、甲醇等為還原劑,一般都必須有催化劑存在才能使反應(yīng)進(jìn)行。
2 活潑金屬還原法
一些活潑金屬,如Cd、Cd-Hg齊、鋁、Devarda合金、鋅、Arndt合金等,在堿性環(huán)境中可以使硝酸鹽還原為亞硝酸鹽或氨氮。
2.1 鋁還原法
Murphy A.P.[2]研究了鋁粉對(duì)飲用水中硝酸鹽氮的還原作用。pH值對(duì)其影響很大,并且水中的硫酸鹽硫也有可能同時(shí)被還原。當(dāng)pH<8時(shí),投入鋁粉不會(huì)使硝酸鹽氮和硫酸鹽硫還原;而當(dāng)pH>11.5時(shí),水中同時(shí)發(fā)生硝酸鹽氮和硫酸鹽硫的還原反應(yīng);只有在9<pH<10.5時(shí),才可以優(yōu)先還原硝酸鹽氮。反應(yīng)的主要產(chǎn)物為氨氮(60%~95%),其次為亞硝酸鹽氮和氮?dú)猓磻?yīng)在十幾分鐘內(nèi)就可以完成。這一工藝有兩個(gè)主要缺點(diǎn):一是需要精確控制體系的pH值,否則易于發(fā)生鋁粉的鈍化,并因與水或硫酸鹽的反應(yīng)增加鋁粉用量;二是主要的反硝化產(chǎn)物是氨氮和亞硝酸鹽氮,它們?cè)陲嬘盟械脑试S濃度都比硝酸鹽氮低得多,因而必須在后續(xù)處理中加以脫除。
2.2 鐵還原法
鐵還原法是被研究得最多的課題。Yong G.K.等人[3]在1964年就嘗試以鐵粉作還原劑脫除飲用水中硝酸鹽氮,由于約75%的硝酸鹽氮轉(zhuǎn)化為氨氮,并且反應(yīng)中需要調(diào)節(jié)pH值,作者認(rèn)為這一方法在大規(guī)模飲用水處理中應(yīng)用的前景有限。
20世紀(jì)90年代后,以鐵為還原劑脫除飲用水中硝酸鹽氮的方法重新受到關(guān)注。鐵粉可與硝酸根發(fā)生快速反應(yīng),主要產(chǎn)物為氮?dú)夂蛠喯跛岣偟姆磻?yīng)可用下式表示[4]:
10Fe+6NO3-+3H2O→5Fe2O3+6OH-+3N2
Fe+NO3-+2H+→Fe3++H2O+NO2-
Cheng F.[5]等(1997年)研究了在有氧條件和不同pH值下的325目鐵粉對(duì)硝酸鹽氮的還原作用。反應(yīng)是一個(gè)放熱的過(guò)程(460 kJ/mol),反應(yīng)產(chǎn)物為氨氮和Fe2+:
NO3-+10H++4Fe=NH4++3H2O+4Fe2+
由于反應(yīng)中需要消耗氫離子,因而必須在反應(yīng)過(guò)程中加入酸和采取pH的緩沖措施,否則該反應(yīng)不能進(jìn)行下去。反應(yīng)速度快慢的依次是:pH=5>pH=6>pH=7。
鐵粉還原法的原理都比較相似,故而有著共同的缺點(diǎn):①反應(yīng)中需要比較嚴(yán)格地調(diào)節(jié)pH值;②反應(yīng)后的水中有較多的氨氮和硝酸鹽氮,需要后續(xù)處理。
由于:①鐵的來(lái)源廣泛、價(jià)格低廉;②反應(yīng)速度較快;③除了pH值外,對(duì)環(huán)境(如溫度)并沒(méi)有特別要求。鐵還原法還會(huì)繼續(xù)受到關(guān)注,目前出現(xiàn)了幾種改進(jìn)措施。Chew C.F.等[6](1998年)提出了一種利用鐵為還原劑的反硝化方法,且利用了外加電場(chǎng)產(chǎn)生的電滲和電動(dòng)作用驅(qū)動(dòng)土壤中水流和硝酸根向鐵源遷移。Choe S[7].提出了一種納米鐵粉反硝化法,反應(yīng)須在無(wú)氧條件下進(jìn)行。納米鐵粉(1~100nm)可以將硝酸鹽氮還原為氮?dú)猓磻?yīng)后的水中幾乎沒(méi)有其他中間產(chǎn)物和氨氮。在室溫條件下反應(yīng)迅速、脫硝完全,且無(wú)需調(diào)節(jié)pH值。如果納米鐵粉的成本不太高,這一方法應(yīng)該有相當(dāng)?shù)膽?yīng)用前景。
2.3其他方法
除鋁和鐵的還原法外,有一項(xiàng)日本專(zhuān)利[8]提出了以鋅為還原劑脫除廢水中硝酸鹽氮的方法,主要的反應(yīng)產(chǎn)物也是氨氮、亞硝酸鹽氮和氮?dú)狻H粼谝环N未加以說(shuō)明的催化劑的作用下,反應(yīng)過(guò)程產(chǎn)生的亞硝酸鹽氮將與氨氮相互作用,使最終反應(yīng)產(chǎn)物以氮?dú)鉃橹鳌?br> 活潑金屬還原法的主要缺點(diǎn)在于反應(yīng)的產(chǎn)物難以無(wú)害的氮?dú)鉃橹鳎⑶視?huì)產(chǎn)生金屬離子、金屬氧化物或水合金屬氧化物等的二次污染,因而對(duì)后處理要求較高,同時(shí)也使這類(lèi)方法的應(yīng)用前景受到影響,而應(yīng)用于污水脫硝可能更為合適。
3 化學(xué)催化反硝化法
化學(xué)催化反硝化研究始于20世紀(jì)80年代末,德國(guó)學(xué)者Vorlop K.D.等人[9]最早提出以通入的氫氣為還原劑,在負(fù)載型的二元金屬催化劑(如PdCu-Al2O3)的作用下,將硝酸鹽氮還原。
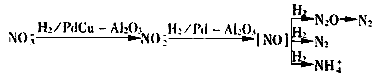
在理論上,只要合理選用催化劑和控制反應(yīng)條件,通過(guò)化學(xué)催化反硝化完全可以將硝酸鹽氮全部還原為氮?dú)狻;瘜W(xué)催化劑的催化活性可以比生物反硝化酶的活性高30倍以上。由于上述過(guò)程可以在地下水的水質(zhì)和水溫條件下進(jìn)行,若以氫氣為還原劑還不會(huì)對(duì)被處理水產(chǎn)生二次污染,因此這一工藝原理受到密切關(guān)注,并被認(rèn)為是最有發(fā)展前景的飲用水脫硝工藝。
催化劑多為貴金屬,如Pd,Pt,Ru,Ir,Rh等。研究表明,Pd是將硝酸鹽氮還原為氮?dú)獾淖罴汛呋瘎?sup>[10]。鈀對(duì)NO3-→NO2-反應(yīng)的催化效果并不理想,如在鈀的表面摻以銅、錫、銦(輔助催化劑)等金屬,則催化效果將大有改善,但這種二元合金催化劑對(duì)自NO2-以后的各反應(yīng)步驟均無(wú)此作用。
催化反硝化是一個(gè)異相催化過(guò)程,唯有位于表面的金屬原子才具備催化活性,因此應(yīng)設(shè)法增加催化劑的比表面積。通常將活性金屬以很薄的一層(幾十nm)負(fù)載于惰性物質(zhì)上,如氧化鋁、氧化硅、沸石等,并制成一定形狀的顆粒。這樣既增加了活性金屬的比表面,又使得在反應(yīng)后易于實(shí)現(xiàn)催化劑與出水的分離。研究表明,催化劑載體的性質(zhì)(如酸堿性)對(duì)催化反硝化過(guò)程有一定影響[11]。
影響水中催化反硝化反應(yīng)的因素有很多,其中既有熱力學(xué)方面的,更有動(dòng)力學(xué)方面的。一些反應(yīng)中間過(guò)程,諸如所有反應(yīng)物、中間產(chǎn)物或最終產(chǎn)物向(或離開(kāi))催化劑表面的傳質(zhì)過(guò)程、吸附與解吸的過(guò)程、表面遷移與反應(yīng)的過(guò)程,都有可能成為反應(yīng)速度的控制步驟,從而影響脫除硝酸鹽的速度和最終反應(yīng)產(chǎn)物的組成,即影響催化活性和選擇性。催化活性(activity)可以用單位質(zhì)量催化劑在單位時(shí)間內(nèi)脫除硝酸鹽氮的量來(lái)表示;催化選擇性(selectivity)可以用某一產(chǎn)物的產(chǎn)率或產(chǎn)量表示,通常指產(chǎn)物為氮?dú)鈺r(shí)的催化選擇性。目前催化反硝化的選擇性可以達(dá)到90%以上,這樣的選擇性還不能保證出水中的氨氮或亞硝酸鹽氮的濃度滿足飲用水的要求。
3.1 催化劑
催化劑的性質(zhì)對(duì)催化反硝化反應(yīng)的速度以及最終產(chǎn)物的組成有至關(guān)重要的影響。在催化劑的設(shè)計(jì)及制備方面雖然有一些理論指導(dǎo),但經(jīng)驗(yàn)的成分仍很多。組成相同的催化劑可能會(huì)因制備過(guò)程的細(xì)微差別而表現(xiàn)出不同的催化性質(zhì)。目前一致認(rèn)為,以金屬鈀為主的二元催化劑最適合充當(dāng)硝酸鹽氮還原的催化劑,而鈀的一元催化劑最適合用來(lái)催化亞硝酸鹽氮的還原反應(yīng)。
輔助催化劑不僅影響催化劑的活性,而且影響催化劑的選擇性[12](如表1)。
同時(shí),不同方法制備的催化劑的最佳配比、活性與選擇性也有比較大的差別[13](如表2)。
注:t=10 ℃,CO(NO-3)=2 mmol/L,pH=5,PH2=113 kPa。
3.2水質(zhì)因素
雖然化學(xué)催化反硝化可以在地下水的水溫、水質(zhì)條件下進(jìn)行,但地下水水質(zhì)組成對(duì)二元(Pd-Cu)催化反硝化的活性和選擇性都有一定的影響。一些研究表明,與用去離子水和硝酸鹽配成的水相比,處理實(shí)際地下水時(shí)的催化反硝化活性和選擇性都有不同程度的下降。水質(zhì)因素的影響表現(xiàn)在以下幾個(gè)方面:a.水中陽(yáng)離子的作用影響硝酸根和氫氧根在水中的遷移速度;b.在催化劑表面形成沉淀或污垢,從而降低催化劑的有效表面;c.水中的陰離子與硝酸根競(jìng)爭(zhēng)表面吸附或活性位置;d.水中可能出現(xiàn)的S2-等使催化劑中毒。
與生物反硝化一樣,催化反硝化對(duì)水中的溶解氧也比較敏感。一方面,氧通過(guò)與硝酸鹽氮爭(zhēng)奪電子而抑制硝酸鹽氮的還原;另一方面,水中的溶解氧還可能導(dǎo)致銅等輔助金屬催化劑被氧化而失活。因此,在化學(xué)反硝化前必須將被處理水中的溶解氧脫除。
Pintar A等(1998年)研究了水中的永久硬度和鹽效應(yīng)對(duì)催化反硝化的影響。研究表明,不同金屬硝酸鹽的反硝化速度不同,硝酸鹽氮在催化劑表面還原反應(yīng)的表觀速度常數(shù)隨陽(yáng)離子的離子勢(shì)的增加而增加:K+<Na+<Ca2+<Mg2+<Al3+。水中的永久硬度對(duì)硝酸鹽氮的還原活性與選擇性都沒(méi)有明顯影響,但重碳酸根對(duì)硝酸鹽氮的還原有很大影響,這可能是由于重碳酸根與硝酸根結(jié)構(gòu)相似,二者在催化劑表面發(fā)生競(jìng)爭(zhēng)吸附所致[14]。
水中的化學(xué)反硝化過(guò)程還有可能受到反應(yīng)器中滋生的微生物影響[15],這種情形在反應(yīng)器的長(zhǎng)期運(yùn)行中無(wú)法避免。這些微生物大多屬于兼性厭氧菌,其中的一些自養(yǎng)菌可以氫氣為電子供體進(jìn)行生物反硝化,但可能僅進(jìn)行到亞硝酸鹽氮,目前對(duì)微生物的復(fù)雜影響的認(rèn)識(shí)還很少。
3.3 pH值和傳質(zhì)過(guò)程
根據(jù)反應(yīng)的電中性原則,在反硝化反應(yīng)過(guò)程中任何消失的陰離子(NO-3或NO-2)或增加的陽(yáng)離子(NH+4)都需要由反應(yīng)中產(chǎn)生的OH-來(lái)平衡:
NO-3+H2=NO-2+H2O
2NO-2+4H2=N2+3H2O+2OH-2NO-2+6H2=2NH+4+4OH-
亦即在反硝化過(guò)程中催化劑與溶液界面處的pH值有升高的趨勢(shì)。
pH值對(duì)催化反硝化的反應(yīng)歷程有很大的影響。隨pH值的升高,無(wú)論是以二元催化劑催化還原硝酸鹽氮,還是以一元催化劑催化還原亞硝酸鹽氮,催化活性都要大幅下降,而氨氮的產(chǎn)率大幅上升。因此,必須采取一定措施來(lái)控制反應(yīng)器內(nèi)的pH值。另外,由于異相催化反硝化反應(yīng)是一個(gè)表面的過(guò)程,為了保證某一表面活性點(diǎn)處的催化活性和選擇性,必須能在該點(diǎn)處保持良好的pH值。也就是說(shuō),一方面應(yīng)使表面反應(yīng)產(chǎn)生的OH-盡快“移走”,另一方面應(yīng)采取措施使溶液內(nèi)部的H+盡快“移入”。因此,在催化反硝化過(guò)程中,除需控制一定的酸度外,還必須使催化劑的所有活性表面與溶液內(nèi)部保持良好的傳質(zhì)效果。
目前大部分工藝使用的負(fù)載型催化劑的顆粒不僅有外部表面,而且有內(nèi)部表面。顯然,顆粒內(nèi)表面與溶液內(nèi)部的傳質(zhì)必定會(huì)面臨一些困難,對(duì)于采用小顆粒催化劑的小型試驗(yàn)系統(tǒng)而言,嚴(yán)格控制催化劑絕大多數(shù)表面微環(huán)境中的pH值并不難,通常通過(guò)補(bǔ)充酸性物質(zhì)(如二氧化碳或硫酸、鹽酸等)及強(qiáng)烈的攪拌即可達(dá)到,然而在中試或生產(chǎn)性系統(tǒng)中,這一問(wèn)題將會(huì)非常棘手。在更大型的系統(tǒng)中,較大粒徑的負(fù)載型催化劑顆粒的內(nèi)表面積在所有表面積中占有更高的比例,加上要在大型反應(yīng)器內(nèi)達(dá)到完全混合均勻并不是件容易的事,因此傳質(zhì)問(wèn)題會(huì)變得更加嚴(yán)重,這是制約催化反硝化工藝實(shí)用化的最關(guān)鍵的難題。
目前在改善傳質(zhì)方面有幾種措施。一種將微粒催化劑和膠體態(tài)催化劑填入中空纖維膜的工藝可以獲得很高的催化選擇性[16]。還有一種將催化劑微粒和膠體包埋于聚乙烯醇凝膠顆粒中的方法也可以獲得較好的催化活性和選擇性。據(jù)報(bào)道這種凝膠顆粒內(nèi)的擴(kuò)散傳質(zhì)性能非常好[17]。
膜催化劑[18~21]在催化反硝化中的應(yīng)用是利用了膜的兩種性質(zhì):a.對(duì)催化劑活性組分的固定作用;b.膜對(duì)參與反應(yīng)的某一相的選擇通過(guò)作用。可以實(shí)現(xiàn)氫氣和被處理水從膜的兩邊進(jìn)入并在催化劑的活性位置產(chǎn)生接觸,從而改善傳質(zhì)效果,但其目前在催化選擇性和活性兩方面的效果還都不甚理想。現(xiàn)又有人提出納米電極催化反硝化法,即將金屬或合金催化劑制成納米顆粒,并使之分散于被處理水中。采用微粒子電極方法,使納米金屬顆粒成為微粒子陰極,通過(guò)微電解過(guò)程在其表面產(chǎn)生氫,并通過(guò)其表面所具備的催化能力,使硝酸鹽氮還原為氮?dú)狻@媚ぜ夹g(shù)實(shí)現(xiàn)納米催化劑與出水分離,并利用碳材料為陽(yáng)極,通過(guò)陽(yáng)極氧化過(guò)程產(chǎn)生的二氧化碳為反硝化反應(yīng)就地補(bǔ)充酸度,并保證反應(yīng)器內(nèi)的還原性環(huán)境。這一方法有以下幾個(gè)主要優(yōu)點(diǎn):a.這種納米金屬顆粒不僅具有巨大的比表面積,而且所有的表面都是外表面,不存在負(fù)載型催化劑所面臨的內(nèi)部傳質(zhì)問(wèn)題,可以同時(shí)獲得高催化活性和選擇性;b.納米金屬顆粒表面通過(guò)微電解產(chǎn)生的氫在產(chǎn)生之初是以原子形式吸附在表面活性位置,因此可以直接用于還原硝酸鹽氮, 而無(wú)需像外加的氫氣那樣需要經(jīng)過(guò)溶解—傳質(zhì)—吸附—解離成原子等一系列的過(guò)程;c.無(wú)需外加pH緩沖劑,反應(yīng)器內(nèi)的自我pH緩沖能力以及良好的傳質(zhì)性能可以使反硝化反應(yīng)在幾乎理 想的pH環(huán)境中進(jìn)行;d.克服了外加氫氣法所面臨的氫氣溶解度低(一般需加壓溶解)、利用率 低以及運(yùn)輸和貯存要求高的缺點(diǎn)。這種僅需輸入電能的工作模式特別適用于小型和分散給水的處理。
4 結(jié)論
在徹底消除地下水中硝酸鹽污染和降低脫硝成本的兩個(gè)方面,生物反硝化方法都是目前已投入實(shí)用的最好的方法。但生物方法仍有兩個(gè)難以克服的缺點(diǎn):①經(jīng)濟(jì)性仍不能令人滿意;②管理要求較高,不適合用于小型或分散給水處理。與生物反硝化方法相比,化學(xué)反硝化方法反應(yīng)速度快,對(duì)操作管理的要求低,具有潛在的經(jīng)濟(jì)性和對(duì)小型或分散給水處理的適應(yīng)性。其中,以鐵還原法為代表的活潑金屬還原法由于還原劑價(jià)格低廉、反應(yīng)速度快等原因而受到一些研究者的關(guān)注。但一般而言,這類(lèi)方法反硝化的主要產(chǎn)物為氨氮,并且需要比較嚴(yán)格地控制pH值,因此只適用于污水脫硝。化學(xué)催化反硝化被一些學(xué)者認(rèn)為是最有前景的地下水脫硝方法。與活潑金屬還原法相比,化學(xué)催化反硝化方法可以將絕大部分硝酸鹽氮轉(zhuǎn)化為氮?dú)?理論上可以使硝酸鹽氮完全轉(zhuǎn)化為氮?dú)?,且可以在地下水的水溫下進(jìn)行,并且催化活性比生物反硝化酶的活性高得多。盡管可以采用其他的一些還原劑,但以氫氣為還原劑仍是研究的主要方向。目前,化學(xué)催化反硝化離實(shí)用化還有相當(dāng)距離,存在的主要問(wèn)題是反應(yīng)過(guò)程中的傳質(zhì)因素影響了催化反硝化的活性和選擇性,這將成為現(xiàn)階段催化反硝化工藝研究的重點(diǎn)。
參考文獻(xiàn):
[1] 范彬,曲久輝,劉鎖祥,等.飲用水中硝酸鹽的脫除[J].環(huán)境污染治理技術(shù)與設(shè)備,2000,1(3):44-47.
[2]Murphy A P.Chemical removal of nitrate from water[J].Nature,1991 ,350:223-229.
[3]Sorg T J.Treatment technology to meet the interim primary drinking water regulat ions for inorganics[J].J AWWA,1978,70(2):105-118.
[4]Siantar D P,et al.Treatment of 1,2-dibromo-3-chloropropane and nitrate -contaminated water with zero-valent iron or hydrogen/pa lladium catalysts[J].Wat Res,1996,30(10):2351-2358.
[5]Cheng F,et al.Reduction of nitrate to ammonia by zero-valentiron[J].Chemosphere,1997,35(11):2689-2696.
[6]Chew C F,Zhang T C.In-situ remediation of nitrate -contaminated ground water by electrokinetics/iron wall process[J].Wa t Sci Tech,1998,38(7):135-146.
[7]Choe S,et al.Kinetics of reductive denitrification by nanoscale zero- valent iron[J].Chemosphere,2000,41:1307-1314.
[8]Yuasa Y,et al.JP08 192 169[96,192,169]JPN.Kokai Tokyo Koho[P].1996-06-30.
[9]Vorlop K D,Tacke T.Erste schritte auf dem weg zur edelmetall-kataly sierten nitr-und nitritentfernung aus trinkwasser[J].Chem Ing Tec h,1989,61:836-845.
[10]Hoerold S,Tacke T,Vorlop K D.Catalytic removal of nitrate and nitrite from drink ing water-1.Screening for hydrogenation catalysts and influence of reaction cond itions on activity and selectivity[J].Environ Tech,1993,14:931-945.
[11]Deganello F,et al.Catalytic reduction of nitrates and nitretes in water solu tion on pumice-supported Pd-Cu catalysts[J].Appl Catal B:Environ, 2000,24:265-268.
[12]Daum J,Vorlop K D.Kinetic investigation of the catalytic nitrate reduction:Construction of the test reactor system[J].Chem Eng Tech,1999,22:19 9-203.
[13]Prusse U,et al.Improving the catalytic nitrate reduction[J].Catal Today,20 00,55:79-88.
[14]Pintar A,Setinc M,Levec J.Hardness and salt effects on catalytic hydrogen of aqu eous nitrate solutions[J].J Catal,1998,174(1):72-79.
[15]Lecloux A J.Chemical,biological and physical constrains in catal ytic reduction p rocesses for purification of drinking water[J].Catal Today,1999,53:23-28.
[16]Hanlein M,et al.Preparation of microscopic catalysts and colloids for cataly sts nitrate and nitrite reduction and their use in a hallow fibre dialyser loop reactor[J].Prep Catal(Ⅶ),1998,118:99-107.
[17]Prusse U,et al.Encapsulation of microscopic catalysts in polyvinyl alcohol h ydrogel beads[J].Prep Catal(Ⅶ),1998,118:137-146.
[18]Strukul G,et al.Use of palladium based catalysts in the hydrogenation of nit rates in drinking water:from powders to membranes[J].Catal Today,2000,55:139- 148.
[19]Ludtke K,et al.Nitrate removal of drinking water by means of catalytically a ctive membranes[J].J Membrane Sci,1998,151:3-12.
[20]Ilinitch O M,et al.Catalytic membrane in reduction of aqueous nitrates:opera tional principles and catalytic performance[J].Catal Today,2000,50:137-146.
[21]Daub K,et al.Studies on the use of catalytic membranes for reduction of nitr ate in drinking water[J].Chem Eng Sci,1999,54:1577-1586.
E-mail:fanbinsy@tsinghua.edu.cn
收稿日期:2001-07-24
論文搜索
月熱點(diǎn)論文
論文投稿
很多時(shí)候您的文章總是無(wú)緣變成鉛字。研究做到關(guān)鍵時(shí),試驗(yàn)有了起色時(shí),是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫(xiě)下來(lái)吧!投稿時(shí),請(qǐng)以附件形式發(fā)至 paper@h2o-china.com ,請(qǐng)注明論文投稿。一旦采用,我們會(huì)為您增加100枚金幣。








