類Fenton反應中吸光度變化及過氧化氫的分解動力學研究
| 論文類型 | 技術與工程 | 發表日期 | 2001-11-01 |
| 來源 | 第二屆環境模擬與污染控制學術研討會 | ||
| 作者 | 高迎新,楊敏 | ||
| 摘要 | 高迎新 楊敏 (中國科學院生態環境研究中心,環境水化學國家重點實驗室,北京 100085) 酸性條件下過氧化氫能被二價鐵離子(稱為Fenton試劑)和三價鐵離子(稱類Fenton試劑)催化分解并產生氧化能力很強的羥基自由基,這一反應已經在有機合成化學和廢水處理中得到比較廣泛的應用(Walling, 19 ... | ||
高迎新 楊敏
(中國科學院生態環境研究中心,環境水化學國家重點實驗室,北京 100085)
酸性條件下過氧化氫能被二價鐵離子(稱為Fenton試劑)和三價鐵離子(稱類Fenton試劑)催化分解并產生氧化能力很強的羥基自由基,這一反應已經在有機合成化學和廢水處理中得到比較廣泛的應用(Walling, 1975)。在Fenton反應體系中,亞鐵離子與過氧化氫接觸后迅速被氧化成三價鐵離子,隨后的H2O2分解反應實際上是在三價鐵控制下進行的。可見類Fenton反應在H2O2催化分解過程中有著非常顯著的意義。
近年來有關類Fenton反應的研究比較多,eq.1-4所示的主要反應步驟已被多數學者接受。有關H2O2分解動力學以及對H2O2分解動力學有著重要影響的鐵離子中間絡合形態的研究也有一定的報告 (Barb, 1949,1951; Walling, 1974;De Laat et al, 1999)。然而,至今為止還沒有一個得到廣泛承認的動力學表達式。
Fe3+ + H2O2 → Fe(OOH)2+ + H+ (1)
Fe(OOH)2+ →Fe2+ + HO2· (2)
Fe2+ + H2O2 → Fe3+ + HO· + HO- (3)
Fe3+ + HO2· →Fe2+ + O2 + H+ (4)
本文根據類Fenton反應中吸光度的變化對三價鐵的絡合形態進行了系統研究,根據實驗結果提出了一種新的中間產物假設并利用吸光度以及自由基濃度的變化進行了驗證。同時,對H2O2分解動力學進行了研究,并計算了動力學參數。
1 實驗部分
1.1 材料
(1)0.1mol·l-1 Fe2(SO4)3儲備液:取一定量的Fe2(SO4)3溶于一定體積的去離子水中,用EDTA滴定法測定其濃度。儲備液當天使用當天配制。
(2) 0.3mol·l-1 H2O2 貯備液:取一定量30%的H2O2用去離子水稀釋,以硫代硫酸鈉標定其濃度并避光保存。
(3)DMPO溶液(5,5-二甲基-1-吡咯啉基-氮氧化物):取一定量的DMPO配制成50mmol/l。
1.2 主要儀器:U-3010(HITACHI)紫外可見光分光光度計,SPM-10 pH 計,HITACHI Z-6100型原子吸收儀,Bruker ER-200D-SRC分光光度計。
2 實驗結果與討論
2.1不同 H2O2濃度對吸光度的影響
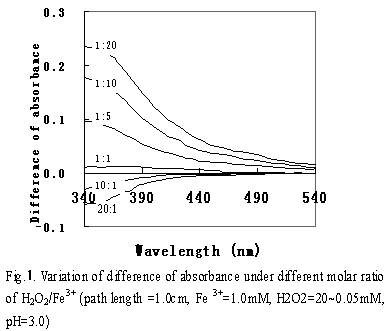 圖1是以1.0mM、pH3.0的鐵溶液為空白,對加入不同濃度H2O2的鐵溶液進行波長掃描的結果。pH3.0時Fe(III)主要以Fe(OH)2+形式存在,Fe(OH)2+在290-400nm之間有較強的吸收。加入H2O2后,當H2O2/Fe3+為1:1時,吸光度差接近于零。隨著H2O2/Fe3+的降低,吸光度差有遞增趨勢,表明有吸光系數大的物質產生,該物質可能就是De Laat et所推測的物質Fe(OH)OOH+。當H2O2/Fe3+大于1:1以上時,隨著H2O2/Fe3+的增大,吸光度差呈負的遞增趨勢,表明隨著H2O2比率的增加,出現了一種吸光度小的物質,該物質可能以類似于 Fe(OH)2+-H2O2絡合物的形式存在。式5和6是溶液中可能發生的反應。
圖1是以1.0mM、pH3.0的鐵溶液為空白,對加入不同濃度H2O2的鐵溶液進行波長掃描的結果。pH3.0時Fe(III)主要以Fe(OH)2+形式存在,Fe(OH)2+在290-400nm之間有較強的吸收。加入H2O2后,當H2O2/Fe3+為1:1時,吸光度差接近于零。隨著H2O2/Fe3+的降低,吸光度差有遞增趨勢,表明有吸光系數大的物質產生,該物質可能就是De Laat et所推測的物質Fe(OH)OOH+。當H2O2/Fe3+大于1:1以上時,隨著H2O2/Fe3+的增大,吸光度差呈負的遞增趨勢,表明隨著H2O2比率的增加,出現了一種吸光度小的物質,該物質可能以類似于 Fe(OH)2+-H2O2絡合物的形式存在。式5和6是溶液中可能發生的反應。
Fe(OH)2++H2O2→Fe(OH)2+-H2O2 (5)
Fe(OH)2+-H2O2→Fe(OH)OOH+ + H+ (6)
2.2吸光度與反應時間的關系
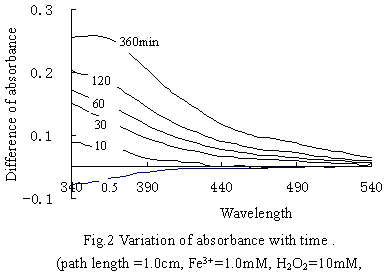
圖2為吸光度差隨反應時間的變化。可以看出,溶液的吸光度隨著H2O2的分解而逐漸增大。隨著H2O2濃度的降低,可能是Fe(OH)2+-H2O2逐漸分解而形成吸光度較高的中間產物Fe(OH)OOH+。
2.3 H2O2 濃度對自由基產量的影響
類Fenton反應中產生的OH·自由基已經通過ESR(電子自旋共振波譜)得到證實。本研究結果表明,自由基的產生量隨著H2O2/Fe(III)增加而逐漸減少,也就是說H2O2的分解速率隨著H2O2濃度的增加而下降。這一結果間接證明了類似于 Fe(OH)2+-H2O2絡合物的存在。H2O2濃度越高,Fe(III)被絡合得越穩定從而降低了它的活性。
2.4 H2O2分解動力學研究
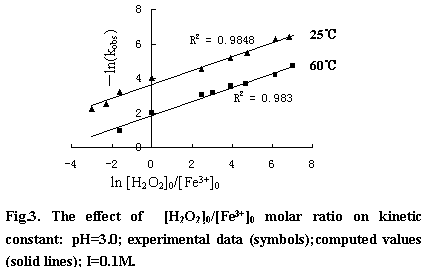
類Fenton反應中,H2O2的分解屬假一級反應。在pH1-2.8范圍內隨著pH的增大反應速率常數也隨著增大。隨后再隨著增大而減少。最佳范圍為pH2.5-3.5(圖略)。H2O2的分解速率也受溶液中陰離子種類的影響,在相同離子強度下,影響程度依次為:磷酸根>>氯根>硝酸根>高氯酸根。它們對H2O2分解速率的影響可能與其同鐵離子的親合力有關,親合力越大的陰離子其影響也就越大。圖3為H2O2分解速率常數與[H2O2]0/[Fe3+]0的關系。可以看出,反應速率常數與[H2O2]0/[Fe3+]0成指數關系。根據Arrhenius 公式求得速率常數公式:
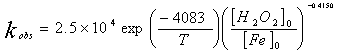
3.結論
1.根據吸光度的變化,可以推測出在類Fenton反應有類似于[ Fe(OH)-H2O2的絡合物存在。類Fenton反應中吸光度隨時間的變化和自由基的產量變化也間接地支持這一推測。
2.類Fenton反應中,H2O2的分解屬假一級反應。最佳pH范圍是2.5-3.5。
3.不同陰離子對H2O2的分解速率影響也不一樣,其影響順序為:磷酸根>>氯根>硝酸根>高氯酸根。H2O2的分解速率與(H2O2/Fe3+)摩爾比成一定有指數關系。
論文搜索
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








