飲用水過氧化氫預氧化生產性試驗研究
| 論文類型 | 技術與工程 | 發表日期 | 2001-10-01 |
| 來源 | 中國土木工程學會水工業分會給水委員會第八次年會 | ||
| 作者 | 周克釗,熊易華 | ||
| 摘要 | 過氧化氫預氧化是取代預氯化的有效的、方便的、經濟的辦法。本研究采用人工錳砂催化劑,地面水水廠濾池中的石英砂經過長時間運行后,會自然熟化成為催化性能良好的人工錳砂。出廠水水質良好,主要指標皆優于國家標準。過氧化氫預氧化去除的主要是溶解性有機物,而不是非溶解性的有機物。過氧化氫對于藻類有著明顯的抑制作用。過濾前的氯仿相當于原水的本底值,而預氯化產生的氯仿則很多。流程濾后水、消毒后的濾后水的氯仿,以及消毒引起的氯仿增加量,皆比預氯化流程的少得多。過濾前后氯仿的變化,說明過氧化氫在催化過濾過程中可以氧化出少量有效 | ||
周克釗 熊易華
中國市政工程西南設計研究院,成都市星輝中路11號,610081
提要 過氧化氫預氧化是取代預氯化的有效的、方便的、經濟的辦法。本研究采用人工錳砂催化劑,地面水水廠濾池中的石英砂經過長時間運行后,會自然熟化成為催化性能良好的人工錳砂。出廠水水質良好,主要指標皆優于國家標準。過氧化氫預氧化去除的主要是溶解性有機物,而不是非溶解性的有機物。過氧化氫對于藻類有著明顯的抑制作用。過濾前的氯仿相當于原水的本底值,而預氯化產生的氯仿則很多。流程濾后水、消毒后的濾后水的氯仿,以及消毒引起的氯仿增加量,皆比預氯化流程的少得多。過濾前后氯仿的變化,說明過氧化氫在催化過濾過程中可以氧化出少量有效氯,但比預氯化投加的少得多。過氧化氫可以氧化分解水中低分子量的有機物(有機氯的前體物),但難以氧化分解較大粒徑的非溶解性有機物。綜上所述,長時間、大規模的生產性試驗證實了過氧化氫預氧化本身產生的有效氯很少,并且可以顯著去除水中低分子量有機物,從而顯著減少了消毒產生的有機氯;明顯抑制藻類生長;可以采用普通石英砂濾池。
1 綜述
由于氯具有廣譜、高效的滅活作用和低廉的運行費用,已經成為自二十世紀初以來普遍使用的飲用水消毒劑。隨著水源污染日益嚴重,不僅消毒加氯量增加,而且為了保證水處理系統正常運行,還常常對原水加氯預氧化,預加氯量比消毒加氯量大得多。氯在水中可與許多有機物生成鹵代物(TOX),其中三鹵甲烷(THM)的含量尤為突出,它們都是已知的對人體健康極為有害的致癌物質,已引起各國的高度重視。世界衛生組織推薦THM控制指標為30 μg/1,美國規定為100 μg/1,我國試行為60 μg/1。
為了控制飲用水中THM,提高飲用水質量,國內外已進行了許多研究[1、2、3、4、5],主要從尋找取代氯的消毒劑和改進水處理工藝兩方面著手。
目前可取代氯的消毒劑主要有NH2Cl、BrCl、O3和ClO2等。這些消毒劑在控制THM方面起到了積極作用,但仍存在各自的弱點,如前兩種由于在一般條件下消毒效果不佳而被否定,且當同時存在其它消毒劑時NH2Cl還會形成亞硝酸鹽或難聞的二氯胺。O3和ClO2的應用相對較多,但ClO2可分解產生有害的亞氯酸鹽,使用O3也會產生許多中間產物,其中一些是對人體有害的誘變劑和致癌物。所以ClO2的使用量受到嚴格限制,O3用于消毒飲用水仍有爭議。總之,至今尚無理想的可完全替代氯的消毒劑。
要消除飲用水中的THM,根本措施在于改善原水水質條件或通過改進水處理工藝去除水中存在的THM前驅物(有機物)。目前在改進水處理技術以減少有機污染物方面,除強化常規處理外,還發展了預處理和深度處理。預處理包括生物預處理、臭氧和高錳酸鉀等化學藥劑預氧化等。深度處理包括顆粒活性炭技術、臭氧-生物活性炭技術等。
H2O2預氧化和消毒,國外已經進行了一些研究[6、7、8、9、10、11、12、13、14],但由于一些技術問題尚未解決,還沒有大規模的工程應用。
純H2O2是淡藍色粘稠液體,常見產品為3%和30%左右的水溶液,比較穩定,但受熱或見光會加速其分解。H2O2的氧化還原電位(1.77,0.88)僅次于O3(2.07,1.24),高于高錳酸鉀、次氯酸、二氧化氯等強氧化劑。因此,H2O2是一種相當強的氯化劑,可以直接氧化水中的有機物污染物以及構成微生物的有機物質,故有著良好的預氧化和消毒功能。H2O2本身只含氫和氧兩種元素,自身分解成H2O和O2,使用中不會引入任何雜質。此外,在飲用水的pH等條件下,H2O2分解速度慢,同有機物作用溫和,可以保證較長時間的殘留消毒作用,因此H2O2是較為理想的飲用水預氧化劑和消毒劑。
H2O2用于消毒時,細菌對H2O2的敏感度與細胞中合成的過氧化氫酶密切相關。過氧化氫酶合成量隨培養基成份、細菌生長期而改變,且具有不耐熱性。由此,培養基成份,生長期及溫度在細菌對H2O2的敏感度中起著重要作用。不過,只有當H2O2濃度與過氧化氫酶濃度相比不過量時,才能觀察到細胞中酶濃度與細胞對H2O2敏感度的關系。H2O2作用于細菌的部位為細胞膜、核糖體和巰基(-SH)。
研究發現,H2O2單獨使用時消毒能力相對較弱,但是當它與金屬離子(Cu2+、Ag+、Fe3+等)、紫外線(UV)和臭氧(O3)等聯合使用時,可大大提高其消毒效果。
金屬離子Fe3+、Cu2+、Ag+本身具有殺滅和抑制微生物(細菌或病毒)的能力,同時又是分解H2O2的催化劑,它們與H2O2配合使用,可發生協同作用,消毒效果大大增強。例如,Ag+和H2O2分別單獨作用于大腸桿菌(5×105 cfu/ml),H2O2表現出比Ag+更低的消毒能力。H2O2濃度分別為5 ppm時,降低細菌的對數值為0.18~0.65,而Ag+分別為5 ppb和30 ppb時,降低細菌的對數值可達0.57~2.87。將Ag+/H2O2復合物作用大于腸桿菌,可以看到滅活力比二者單獨使用時滅活效力之和強30倍。同時,在H2O2和Ag+濃度較低時,表現出協同作用增強的趨勢。
Fe3+和Cu2+都可滅活病毒,但H2O2與Cu2+的協同作用強于它與Fe3+的協同作用。21℃時,作用于Junin病毒(105~106 cfu/ml)30 min后的半致死濃度ID50,Cu2+為25 mg/l,H2O2為110 mg/l,但當H2O2與Cu2+一起作用,則當H2O2為7mg/l時,Cu2+的ID50則降至0.07 mg/l。當Cu2+為3.17 mg/l時,加入不同濃度的H2O2使H2O2:Cu2+(mg:mg)從0:1變為54:1,則病毒存活率從76%左右降低至0。而且Cu2+和H2O2混合試劑的效力可持續22小時以上。研究還發現,若加入金屬螯合物(如氮基三醋酸鈉鹽NTA),則H2O2與金屬離子混合物殺滅微生物的能力會進一步增強。如以四分之一ID50的濃度按1:1(mg/l:mg/l)混合的Fe3+/H2O2復合物,當加入NTA后,對病毒的滅活力增加4至7倍,而相同濃度的Fe3+或NTA,無論是單獨還是混合都無滅活能力。NTA與金屬離子混合后再作用于微生物,效果最好。
對原水試驗研究表明,單獨用H2O2殺死大腸桿菌(106/ml),最低有效濃度為5~10 mg/l,滅活病毒是6~10 mg/l,接觸時間需2小時。由于國外飲用水衛生標準中H2O2最高允許濃度為3 mg/l,這就使得H2O2消毒的應用受到限制。為了將H2O2濃度控制在3 mg/l以下,曾用Cu2+或Ag+作催化劑。結果表明,加入催化劑后,H2O2消毒效果激增。H2O2 3 mg/l在Ag+ 0.2 mg/l催化下,只需10分鐘即可殺死全部大腸桿菌。若用同樣濃度的Cu2+催化,效果更佳,只需5分鐘。而且H2O2在催化消毒情況下,H2O2、Cu2+、Ag+都滿足衛生標準。
H2O2也可與Cu2+和抗壞血酸(VC)一起進行三元協同消毒。先加入H2O2 5 mg/l,然后加入VC 10 mg/l和Cu2+ 0.5 mg/l,接觸1小時后大腸桿菌滅活率可達99.2%。三元協同消毒的藥物投加順序不得改變,否則消毒效果會降低。
H2O2能提供自由基(OHo),這是已知活性最強的物質之一,相對氧化力為2.06,僅次于氟(2.23)而高于臭氧。通常有兩種方法可使H2O2轉變成自由基:即亞鐵催化(芬頓試劑法)和紫外線(UV)催化。硫酸亞鐵與H2O2產生的OHo,滅活大腸桿菌速度可比H2O2單獨作用時快3倍;UV與H2O2聯用產生的OHo,對幾組細菌的滅活速度可比兩者單獨使用時快150~4000倍。
H2O2用于預氧化,主要是利用H2O2與其它物質產生的OHo的強氧化作用,去除一些大分子有機物如農藥等。例如H2O2單獨使用時不能氧化殺蟲劑莠去津,而當H2O2與UV聯用時,在不到15分鐘的時間內可去除莠去津99%以上。芬頓試劑處理莠去津時,FeSO4與H2O2最佳濃度比為1:1,在30秒內莠去津即可被降解。同時,pH對降解效率影響很大,pH=3時,為99%;而pH=9時,只有37%。另外,H2O2與O3聯用可去除受污染地下水中的三氯乙烯、四氯乙烯等物質。在去除許多難以氧化的難聞物質方面,H2O2與O3聯用的工藝優于單獨O3或H2O2氧化。
此外,作為水的預處理劑,H2O2還可用作除藻劑。它可破壞藻類中含有的膽蛋白質、胡蘿卜素和葉綠素等。其作用于顫藻屬的最低濃度為1.75 ppm。過氧化氫去除藍藻效果優于綠藻。
綜上所述,過氧化氫是一種有著廣泛應用前景的預氧化劑和消毒劑,將它與金屬離子或紫外線等配合使用,可達到很好的效果。
目前國外消毒中常用的H2O2催化劑為Cu2+或Ag+,都屬重金屬離子。雖然投量在衛生標準以下,但畢竟是有害物質,難以令人滿意。紫外線則設備復雜,耗電量大,推廣使用難度較大。
從另一個角度來看,Cu2+、Ag+或紫外線的作用,都是使H2O2迅速分解,既然如此,能促使H2O2迅速分解的其它催化劑,似乎也應該具有強化H2O2預氧化和消毒的功能。
理想的用于飲用水中H2O2預氧化和消毒的催化劑,應該是安全無毒,最好不溶于水,以免把雜質引入水中。可滿足這一要求的催化劑,可以考慮應用廣泛的MnO2催化劑(包括國外最近出現的C-Mn催化劑)。
據報道,MnO2尤其是水合MnO2,本身具有較強吸附性和氧化性,可去除水中許多有機污染物,而且,MnO2在H2O2的分解中具有較強的催化劑活性。研究表明,MnO2制備方法不同,其催化活性也不一樣。活性的大小與催化劑的多種物化特性相關,包括活性氧、表面剩余氧、表面OH群、晶狀改變、晶格參數和熱分解數據。在不同類型的MnO2催化下,H2O2分解遵循不同的動力學規律,表現為一級或二級反應。當MnO2中含有CuO時,H2O2分解遵循一級反應動力學。根據30℃每秒每克催化劑放出的氧氣的體積數表示的H2O2分解初始速率,比較8種不同方法制備的MnO2催化劑活性,結果顯示出將Mn(II)和Cu(II)硝酸鹽溶液加入到KMnO4溶液(摩爾比2:3)中,得到的MnO2催化活性最高。
本子專題研究的目的在于通過考察H2O2在MnO2(或C-Mn)催化下的預氧化和消毒作用,尋找最佳的催化劑和運行參數,以應用于H2O2預氧化和消毒的實際工程中。
2 工作過程和示范工程
1998年3月,過氧化氫預氧化小試全部結束;1999年11月,成都自來水公司龍泉水一廠過氧化氫生產性試驗改造工程結束,生產性試驗開始進行;2000年12月,生產性試驗全面完成。
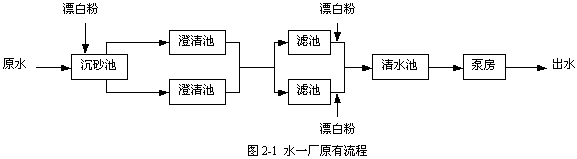
成都自來水總公司龍泉自來水公司水一廠原有流程見圖2-1。
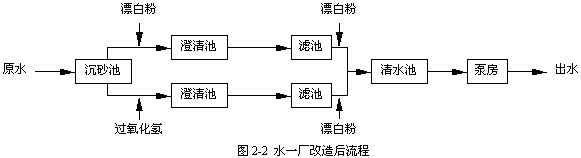
為了保證水一廠在過氧化氫預氧化生產性試驗期間至少有一半正常供水能力,同時為了能夠進行試驗流程和常規流程的對比試驗,水一廠原有流程被改造為兩套獨立的并行流程:預氯化流程和過氧化氫預氧化流程,見圖2-2。
水一廠改造工程包括:
· 澄清池與濾池間管道改造,約30米;
· 過氧化氫投加設備添置,包括溶液槽1套,計量泵1臺,以及配套的管道和閥門;
· 2座濾池中的1座由普通石英砂濾池改為石英砂催化劑濾池,人工錳砂濾料購自雙流自來水公司。
濾池改造以后發現,濾池中替換出的石英砂呈深褐色,經試驗,對過氧化氫具有強烈的催化作用,證明這些石英砂已經自然熟化成為性能良好的人工錳砂,濾池改造其實并不必要。因此,以后過氧化氫預氧化流程的新建和改造,可以不再采用價格較貴的人工錳砂,采用普通石英砂就可以達到同樣效果,這樣更加方便,而且節約大量費用。
眾所周知,石英砂濾料在地下水運行中可以自然熟化成為人工錳砂,但是,石英砂濾料在地面水運行中也同樣可以自然熟化成為人工錳砂,則未見報導。
由于地面水中同樣含有鐵錳,雖然沒有地下水中多,但這些微量鐵錳也會逐漸沉積在石英砂濾料表面上,運行時間長了,石英砂仍然可以自然熟化成為人工錳砂。自然沉積形成的水合二氧化錳,具有良好的催化性能。
3 試驗概況
過氧化氫預氧化生產性試驗總規模1萬噸/天,其中一半按照原來預氯化方式或不預加氯的常規方式運行,另一半進行過氧化氫預氧化對比試驗運行。
水一廠原水經過沉沙池去除泥沙后,出水一半經預氯化或不預加氯、澄清、過濾和消毒,另一半經過氧化氫預氧化、澄清、人工錳砂催化過濾和消毒,兩部分水匯合后進入清水池,然后加壓出廠。
過氧化氫投加量在5mg/L左右。
27%的商品過氧化氫稀釋成13 g/L左右的藥液投入沉砂池出水,投加流量在1.2 L/min左右。一般每天投藥8小時,消耗過氧化氫1桶25 kg。如果需要,則24小時連續投藥。
常規流程和過氧化氫預氧化流程對比取樣化驗。
過氧化氫預氧化生產性試驗期間,水一廠出水水質良好,主要指標皆優于國家標準,見附表,統計結果見表3-1。這就說明,過氧化氫生產性試驗對于出水水質無任何不良影響。
4 運行參數
過氧化氫生產性試驗的運行參數見附表,統計結果見表4-1,并參見圖4-1~4。
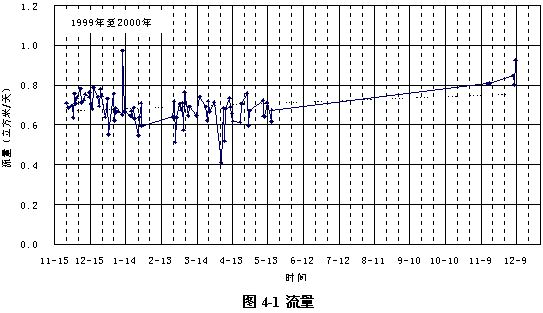
圖4-1顯示了過氧化氫生產性試驗期間水一廠的流量情況,總流量平均為6910 m3/d。過氧化氫預氧化試驗流程的流量未能單獨計量,由于兩套流程完全并列,流量應該一樣,所以進入過氧化氫預氧化流程的流量為總流量的一半,即為3456 m3/d。
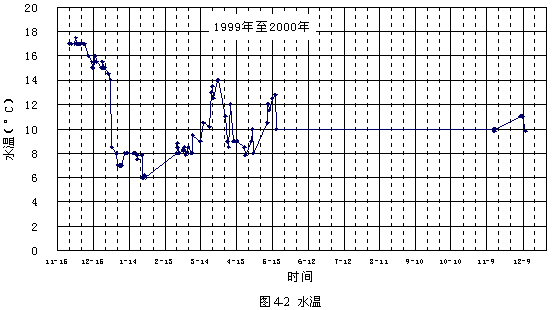
圖4-2顯示了試驗期間水溫的變化情況,水溫在6~18 °C范圍內。
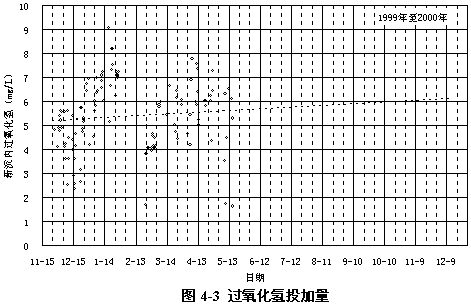
圖4-3顯示了試驗期間過氧化氫投加量的情況,平均投加量為5.37 mg/L。
過氧化氫投加量可以利用試驗中化驗和收集的過氧化氫藥液濃度、投加流量和進入流程流量數據進行計算,但由于過氧化氫藥液濃度和投加流量是瞬時值,而進入系統流量并非瞬時值,所以誤差較大。
這里采用過氧化氫預氧化新系統的沉淀池內進水區的過氧化氫化驗數據作為過氧化氫投加量,雖然該處與投加過氧化氫的沉砂池出口已有一定距離,但距離較短,基本上可以反映投加量。而且沉砂池出口與新沉內之間無法取樣,也只好如此。
預氯化的預加氯量,由于投加的是漂白粉,只能按照工廠值班記錄中的流量、漂白粉投加數量和漂白粉中的有效氯含量計算。根據值班記錄,2000年12月6~8日分別加漂白粉20、50和30公斤,總流量分別為8480、8009和9297 m3/d。漂白粉中有效氯含量一般應在30 %左右,但2000年12月18日曾測定水一廠使用的漂白粉中的有效氯含量,僅為16 %,可能是存放過久的原因。若按照漂白粉正常有效氯含量計算,這三天的預加氯量應該平均為2.33 mg/L;若按實測有效氯計算,則這三天的實際預加氯量平均為1.24 mg/L。
根據龍泉自來水公司生產計劃科介紹,平時預加氯量為3 mg/L左右。1999年11月過氧化氫預氧化生產性試驗開始進行以后,常規系統于同年12月2日后停止了預加氯,直到2000年12月6日才又根據試驗要求開始預加氯。

圖4-4顯示了進入試驗系統的原水高錳酸鉀指數,大致在2~3 mg/L范圍內。
該原水系指水一廠的沉砂池出水。2000年12月11日曾測定與該廠進廠水和沉砂池出水的高錳酸鉀指數,分別為2.70和2.59 mg/L,二者相近。
5 過氧化氫
過氧化氫預氧化生產性試驗中過氧化氫的數據見附表,統計結果見表5-1。
過氧化氫(mg/l) 由表5-1可以看出,沉淀池出水中的過氧化氫為4.70 mg/l,比沉淀池進水的5.37 mg/L減少12 %。這部分減少的過氧化氫主要是與水中的有機物反應消耗了。
濾池出水中的過氧化氫,試驗中曾多次化驗,皆在檢出限以下,故未在表中列出。這就說明濾池出水中不含過氧化氫,過氧化氫預氧化對于飲用水是安全的。
6 高錳酸鉀指數
過氧化氫預氧化生產性試驗中高錳酸鉀指數的數據見附表,統計結果見表6-1。
6.1 常規系統
圖6-1顯示了常規系統沉淀池進出水高錳酸鉀指數的變化情況。常規系統沉淀池出水高錳酸鉀指數與進水的相比,僅平均減少9.25 %。減少的原因,應該是原水中的非溶解性有機物被絮凝沉淀過程部分去除了。
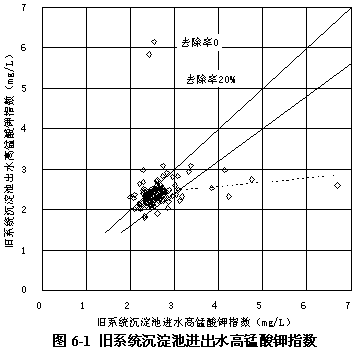
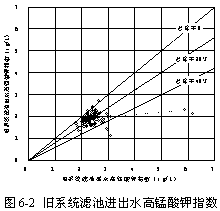
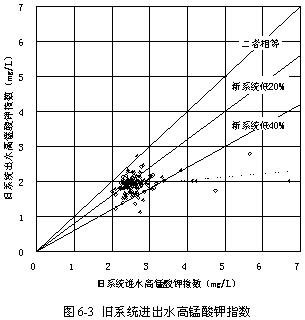
圖6-2顯示了舊系統濾池進出水高錳酸鉀指數的變化情況,出水高錳酸鉀指數與進水相比平均減少20.66 %。減少的原因,應該是原水中的非溶解性有機物被過濾過程去除。
圖6-3顯示了常規沉淀和過濾全套系統進出水高錳酸鉀指數的變化情況,平均減少28.09 %,說明常規流程具有很強的去除有機物的能力。
6.2 過氧化氫預氧化系統
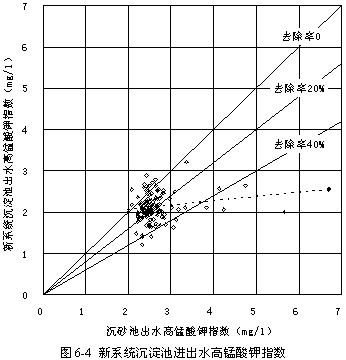
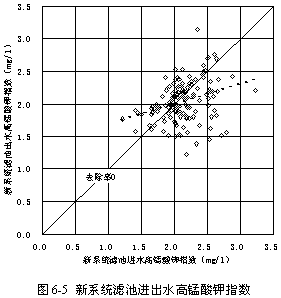
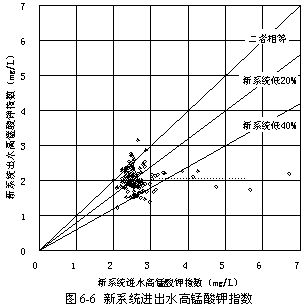
圖6-4顯示了過氧化氫預氧化系統的沉淀池進出水高錳酸鉀指數的比較,可見出水高錳酸鉀指數與進水相比顯著降低,平均減少19.87 %,是常規系統沉淀池的減少幅度的2.12倍,說明過氧化氫預氧化流程中的沉淀過程去除有機物的能力比常規流程中的高得多。
圖6-5顯示了過氧化氫預氧化系統的濾池進出水高錳酸鉀指數的比較,可見濾池出水與進水相比僅減少4.67 %,遠不及常規系統的20.66 %。原因可能是新系統濾料較粗(0.8 mm),而常規系統濾料較細(0.6 mm),故去除非溶解性有機物的能力不如常規系統。
圖6-6顯示了過氧化氫預氧化流程的沉淀和過濾全套系統的進出水高錳酸鉀指數的變化情況,統計平均減少23.82 %,低于常規系統,原因同上。
由于過氧化氫預氧化流程中沉淀過程去除高錳酸鉀指數能力大大高于常規系統,而濾料較粗的過濾過程不及濾料較細的常規系統,說明過氧化氫預氧化去除的主要是溶解性有機物,而不是非溶解性的有機物。
6.3 過氧化氫預氧化系統與常規系統比較
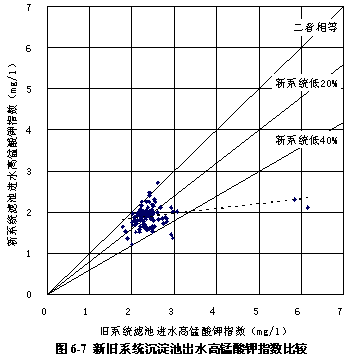
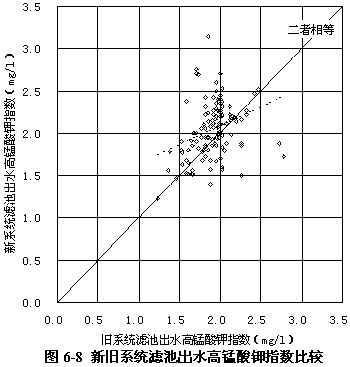
圖6-7 顯示了過氧化氫預氧化系統與常規系統沉淀池出水的高錳酸鉀指數比較,可見新系統沉淀池出水的高錳酸鉀指數要低一些,平均低11.70 %,同樣說明過氧化氫預氧化流程中的沉淀過程去除有機物的能力比常規流程高。
圖6-8顯示了過氧化氫預氧化系統與常規系統濾池出水的高錳酸鉀指數比較,可見二者相差不大,原因同樣是由于新系統濾料較粗而舊系統濾料較細。
7 葉綠素
過氧化氫預氧化生產性試驗在龍泉水一廠進行了沉淀池出水葉綠素含量的考查,見表7-1,并參見圖7-1~3。
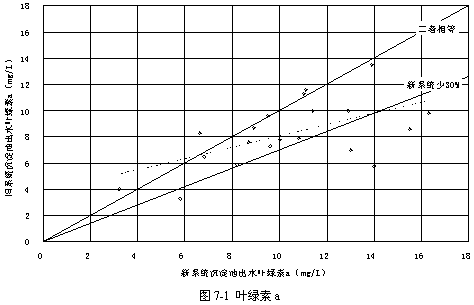
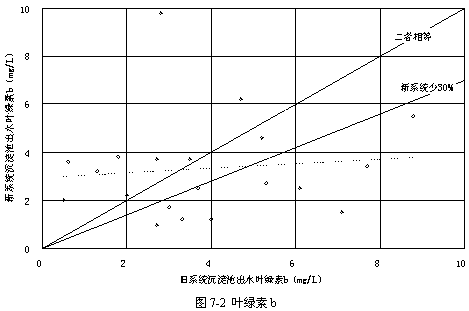
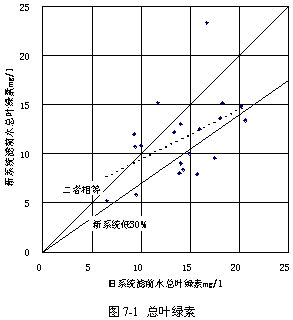
表7-1顯示了過氧化氫預氧化系統與常規系統的沉淀池出水的葉綠素比較,可見投加過氧化氫以后葉綠素a、葉綠素b和總葉綠素皆有顯著的下降,其中葉綠素a平均下降20.56 %,葉綠素b平均下降14.06 %,總葉綠素平均下降18.87 %,證實了過氧化氫對于藻類的確有著明顯的抑制作用。
圖7-1~3顯示了葉綠素a、葉綠素b和總葉綠素的變化情況。
根據文獻介紹,痕量的過氧化氫即可有效抑制藻類的生長,若只需要過氧化氫預氧化抑制藻類,則過氧化氫的投加量還可以大大減少。
8 氯仿
2000年12月,過氧化氫預氧化生產性試驗進行了過氧化氫預氧化與預氯化的對比試驗,以考查水中有機氯的生成情況。
試驗先在成都自來水總公司龍泉自來水公司水一廠進行。由于水一廠的生產性試驗受到出廠水質的限制,預加氯量不得過大,而且預加氯量難以準確計量,所以后來又在水質處進行了預加氯的補充試驗。
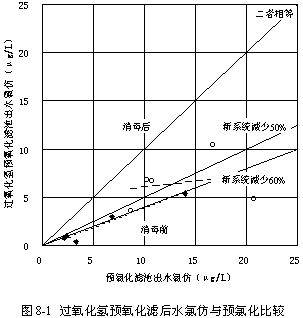
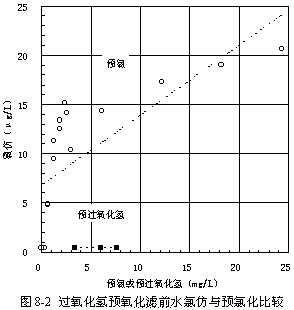
試驗數據見表8-1~2,并參見圖8-1~2。化驗結果表明,所有水樣中的四氯化碳含量皆在檢出限以下,故未在圖表中列出。
由圖8-1可見,過氧化氫預氧化流程的濾池出水消毒前產生的氯仿明顯比預氯化流程的少得多,平均少62.91 %,其原因是過氧化氫預氧化產生的有效氯比預氯化少得多。
值得注意的是,過氧化氫預氧化流程的濾池出水消毒后產生的氯仿,也仍然明顯比預氯化流程的少得多,平均少57.71 %。而且,過氧化氫預氧化濾后水消毒后氯仿平均由2.1 μg/L提高到6.5 μg/L,增加了4.1 μg/L,而預氯化濾后水消毒后氯仿平均由5.7 μg/L增加到13.4 μg/L,增加了7.7 μg/L,消毒后過氧化氫預氧化濾后水增加的氯仿量比預氯化少46.75 %。這就說明,過氧化氫氧化分解了生成有機氯的低分子量前體有機物,所以再與氯接觸時產生的氯仿也少。
對比高錳酸鉀指數的去除效果可以看出,過氧化氫只能有效地氧化分解溶解性的低分子量有機物,而難以氧化分解較大粒徑的非溶解性有機物,這是由于化學反應發生在有機物顆粒表面,所以有機物被氧化分解的程度與其粒徑直接相關。
由表8-2和圖8-2可見,過氧化氫預氧化流程過濾消毒前產生的氯仿明顯也比預氯化流程的少得多。前者<0.4 μg/L(檢出限),等于本底值,僅為后者4.80~20.70 μg/L的2~8 %以下。預加氯的量越大,則產生的氯仿越多。
比較過氧化氫預氧化流程濾前水和濾后水的氯仿含量,濾前水氯?lt;0.4 μg/L,等于本底值,說明流程中的過氧化氫在催化過濾前不會氧化出有效氯;濾后水氯仿2.1 μg/L,高于本底值而低于預加氯,說明在催化過濾過程中過氧化氫可以氧化出少量有效氯,但比預氯化投加的少得多。
9 Ames試驗
2000年11月,將水一廠的原水、過氧化氫預氧化系統濾池出水、常規系統濾池出水和總出廠水委托華西醫科大學公共衛生學院進行Ames試驗,試驗結果見附件。
當時常規流程未預加氯,過氧化氫預氧化投加量為5 mg/L左右,兩個流程在沉淀前皆投加了等量的絮凝劑堿式氯化鋁。
Ames試驗結果指出:
· 原水未檢出致突變性;
· 總出廠水對兩試驗菌株均有較強的致突變性,存在劑量反應關系,檢出致突變性的最低水樣量為1.5升;
· 新系統濾后水和舊系統濾后水,當試驗劑量大于3升/皿時,TA98的回變菌落數有所增加,但是,僅新系統濾后水劑量大于6升/皿時,回變菌落數才大于陰性對照的兩倍,檢出致突變性。
總出廠水Ames試驗檢出致突變性的原因,顯然是消毒時投加的氯引起的。
10 結論與討論
過氧化氫預氧化生產性試驗中發現,地面水水廠濾池中的石英砂經過長時間運行后,同樣會自然熟化成為催化性能良好的人工錳砂,因此,過氧化氫預氧化流程的新建和改造,不必采用價格較貴的人工錳砂,采用普通石英砂就可以達到同樣效果,這樣更加方便,而且節約了大量費用。
過氧化氫預氧化生產性試驗期間,水一廠出廠水水質良好,主要指標皆優于國家標準,說明過氧化氫生產性試驗對于出水水質無任何不良影響。
由于過氧化氫預氧化流程中沉淀過程去除高錳酸鉀指數能力大大高于常規系統,而濾料較粗的過濾過程不及濾料較細的常規系統,說明過氧化氫預氧化去除的主要是溶解性有機物,而不是非溶解性的有機物。
過氧化氫預氧化系統沉淀池出水的葉綠素a、葉綠素b和總葉綠素皆比進水明顯下降,證實過氧化氫對于藻類有著明顯的抑制作用。根據文獻介紹,痕量的過氧化氫即可有效抑制藻類的生長,若僅需抑制藻類,則過氧化氫的投加量還可以大大減少。
過氧化氫預氧化流程過濾前的氯仿相當于原水的本底值,而預氯化產生的氯仿則很多。過氧化氫預氧化流程濾后水、消毒后的濾后水的氯仿,以及消毒引起的氯仿增加量,皆比預氯化流程的少得多。
過氧化氫預氧化流程過濾前后氯仿的變化,說明過氧化氫在催化過濾過程中可以氧化出少量有效氯,但比預氯化投加的少得多。
根據對高錳酸鉀指數和氯仿數據的分析,過氧化氫可以氧化分解水中低分子量的有機物(有機氯的前體物),但難以氧化分解較大粒徑的非溶解性有機物。
綜上所述,長時間、大規模的生產性試驗證實了過氧化氫預氧化的優點,包括:
· 本身產生的有效氯很少,并且可以顯著去除水中低分子量有機物,從而顯著減少了消毒產生的有機氯;
· 明顯抑制藻類生長;
· 可以采用普通石英砂濾池。
因此,過氧化氫預氧化是取代預氯化的有效的、方便的、經濟的辦法。
11 存在問題和建議
過氧化氫預氧化工藝有待在長期的運行實踐中繼續改進完善。
過氧化氫預氧化流程中水質的變化情況有待長期深入監測。Ames試驗是一種間接的方法,而且價格昂貴,難以大量進行。建議加強對直接影響水質的水中微量有機物質的化驗分析,特別是針對有機氯和過氧化氫預氧化的附產物。
過氧化氫預氧化只是取代了預氯化,而后續的氯消毒仍要產生有機氯,所以,為了徹底解決有機氯問題,建議開始進行過氧化氫消毒的研究和應用。
參考文獻
[1]蔣興錦編著,飲水的凈化與消毒,中國環境科學出版社(1989)
[2]陸家訓譯,過氧化氫去除水中各種污染物的應用概況,國外環境科學技術,第67號,1992年第2期。
[3]熊渝斌譯,超聲波/H2O2工藝對溶液中的2-氯酚的降解,手稿。
[4]許保玖,略談近年來給水處理中出現的幾個問題(提綱),中國市政工程西南設計院,1984年8月。
[5]楊福才編譯(自New World Water 1997),飲用水處理的未來趨勢,http//: www. H2O- china. com/ water/ 80. gszj/ 80yfc. yysclwl. htm,2001年1月24日。
[6]Tsu-fen Chen, Ruey-an Doong and Wen-gang Lei, Photocatalytic degradation of parathion in aqueous TiO2 dispersion: the effect of hydrogen peroxide and light intensity, Wat. Sci. Tech. Vol. 37, No. 8, pp. 187-194, 1998.
[7]K. Fajerwerg, J. N. Foussard, A. Perrard and H. Debellefontaine, Wet oxidation of phenol by hydrogen peroxide: the key role of pH on the catalytic behaviour of Fe-ZSM-5, Wat. Sci. Tech. Vol. 35, No. 4, pp. 103-110, 1997.
[8]H. Grigoropoulou and C. Philippopoulos, Homogeneous oxidation of phenols in aqueous solution with hydrogen peroxide and Ferric ions, Wat. Sci. Tech. Vol. 36, No. 2-3, pp. 151-154, 1997.
[9]R. pedahzur, H. I. Shuval and S. Ulitzur, Silver and hydrogen peroxide as potential drinking water disinfectants: their bacter icidal effects and possible modes of action, Wat. Sci. Tech. Vol. 35, No. 11-12, pp. 87-93, 1997.
[10]Monica C. Gonzalez and Daniel O. Martire, Kinetics of Oo? and O3o? in alkaline aqueous solutions, Wat. Sci. Tech. Vol. 35, No.4, pp. 49-55, 1997.
[11]Christian Petrier and Anne Francony, Incidence of wave-frequency on the reaction rates during ultrasonic wastewater treatment, Wat. Sci. Tech. Vol. 35, No. 4, pp. 175-180, 1997.
[12]Angela Unkroth, Volker Wagner and Roland Sauerbrey, Laser-assisted photochemical wastewater treatment, Wat. Sci. Tech. Vol. 35, No. 4, pp. 181-188, 1997.
[13]Soo-M. Kim, Sven-U. Geissen and Alfons Vogelpohl, Landfill leachate treatment by a photoassisted Fenton reaction, Wat. Sci. Tech. Vol. 35, No. 4, pp. 239-248, 1997.
[14]Martin Steensen, chemical oxidation for the treatment of leachate-process comparison and results from full-scale plants, Wat. Sci. Tech. Vol. 35, No. 4, pp. 249-256, 1997.
論文搜索
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








