穩定性二氧化氯溶液中二氧化氯存在形態的研究
賀啟環 謝惠芳
(南京理工大學環境科學與工程系,南京210094)
摘 要 本文首先通過理論分析,以為二氧化氯(ClO2)在穩定性二氧化氯溶液(簡稱穩定液)中存在的形態根據所用穩定劑的不同而有區別。通過對幾種樣品的紅外光譜分析、紙色譜分析、酪氨酸顯色反應及抗酸緩沖能力的測定,證實在以過碳酸鈉為穩定劑的穩定液中,ClO2以亞氯酸根離子(ClO2-)形式存在,并處在一個由NaHCO3-Na2CO3組成的緩沖體系中;在以過H3BO3-NaB4O7硼酸鈉為穩定劑的穩定液中,ClO2可能是以活性配位化合物的形式存在,并處在由組成的緩沖體系中。這一結論對穩定性二氧化氯溶液的生產、貯存和應用是有重要的指導作用。
關鍵詞 二氧化氯 穩定性二氧化氯 二氧化氯形態
Study on present form of chlorine dioxide in stabilized chlorine dioxide solution
He Qihuan Xie Huifang
(Dept. Of Environmental Science & Engineering of Nanjing University of
Science & Technology, Nanjing 210094)
Abstract Firstly depending on theoretical analysis, this paper suggests that chlorine dioxide (ClO2) in stabilized chlorine dioxide aqueous solution (stabilized solution) has different present form because of the different stabilizer used. On the basis of the analytical results of infrared spectrometry,paper chromatography,tyrosine color development reaction and the assay of anti-acid buffer capability, it was confirmed that the chlorine dioxide in stabilized solution with sodium percarbonate as stabilizer is present in the form of a chlorition (ClO2-) and together with NaHCO3—Na2CO3 buffer system. When the stabilizer is sodium perborate, chlorine dioxide may be retained in the solution comprised of H3BO3—Na2B4O7 as a labile complex. These results related above will have important guide effect on product,store and application of stabilized chlorine dioxide solution.
Keywords chlorine dioxide stabilized chlorine dioxide Chlorine dioxide form
1.前 言
由于二氧化氯(ClO2)的不穩定性,一般情況下商業上不便制成壓縮氣體或濃縮溶液(穩定液)是一種將高純度的二氧化氯穩定在穩定劑中所形成的無色惰性混合液。我國已于1966年制定了該產品的行業標準(HG/T2770—1996)。穩定液經加酸活化后可釋放出ClO2來。從現象上看,酸性活化劑的作用是破壞了穩定液的穩定體西從而釋放出原來穩定與其中的二氧化氯來,但二氧化氯分子在穩定液中以何種形態——分子、離子、配位化合物——存在,一直是人們感興趣的問題。因為這一基礎性問題的研究將對穩定性的生產與應用有重要的指導意義。
本課題的一部分內容發表于1997年的《工業水處理》上[1],該文明確指出:ClO2在以過碳酸鈉為主穩定劑的穩定液中是以ClO2-形式存在。本文既是這一結論的背景材料,事隔四年后才發表,相信仍有現實意義。
2.穩定液中二氧化氯存在形態的理論分析
以有的研究表明,二氧化氯(ClO2)在水中溶解成黃綠色的溶液,與氯氣不同,它在水中不水解,也不聚合,在PH=2~9范圍內以一種溶解的氣體存在,具有一定的揮發性;而穩定性二氧化氯溶液是一種無色、基本無味的惰性溶液(相對于ClO2而言),顯然二氧化氯分子在進入穩定劑中后發生了物理、化學作用,分子形態發生了變化,不可能在以原來的ClO2分子形式存在。
一個值得注意的現象是無色的亞氯酸鈉(NaClO2)溶液,用酸性物質酸化后也能反應釋放出ClO2來,反應式如下:
5NaClO2 + 4HCl → 4ClO2 + 5NaCl + 2H2O (2-1)
5個ClO2-生成4個ClO2,其中一個ClO2-作為氧化劑被還原成Cl-。反過來看,用ClO2生產亞氯酸鈉時,在堿性條件(用NaOH)下,用過氧化氫(H2O2)作還原劑,使ClO2還原成ClO2-:
2Cl2+2NaOH+H2O2 → 2NaClO2+2H2O+O2 (2-2)
計算該反應的標準自由焓G=-ZEF=-167.15KJ/mol<0,表明該反應在常溫下可自發進行。這一反應實際上與用堿性過氧化物作穩定劑生產穩定性二氧化氯溶液有相似之處:
2ClO2+2Na2CO3+H2O2 → 2NaClO2+2NaHCO3+O2 (2-3)
這一反應與式(2-2)的區別在于此時的堿性條件是由Na2CO3提供的:
Kh1
CO32-+H2O → HCO3-+OH- (2-4)
Kh2
HCO3-+H2O → H2CO3+OH- (2-5)
其中水解常數Kh1=1.8×104,Kh2=2.3×10-8,可見Kh1>>Kh2,故以第一步水解為主。因此有理由認為,ClO2-是穩定液中ClO2最可能存在的形態。根據Harrison紙層析實驗,1990年就有人提出了這種觀點[2],在實驗中得到的穩定性二氧化氯的色譜斑與純二氧化氯溶液的色譜斑不同,二與亞氯酸鈉溶液的色譜斑相似。
美國專利[3][4]認為穩定性二氧化氯溶液中二氧化氯以某種活性配位化合物(labile complex)的形式存在,并得以穩定。這些專利均采用過硼酸鈉為穩定劑,但未給出其存在的分子式。提出這種觀點是基于以下原因:所形成的穩定性二氧化氯溶液未經二氧化氯在水中的快速分解過程,而二氧化氯又以一種極易釋放的形式存在,在酸化條件下很容易產生氣態二氧化氯。化合物的性能測試表明溶液中存在大量的配位化合物。另一方面,以配位化學的觀點看,二氧化氯中氯原子采用SP2雜化,在其一個雜化軌道上存在著一個孤對電子;而硼原子是缺電子原子,具有接受孤電子對的條件,故它們形成配位物的可能性是存在的。值得注意的是ClO2-的軌道雜化為不等性SP3,具有二個孤電子對,也具有與硼原子形成配位物的能力。
另一份美國專利[5]則認為用過碳酸鈉代替過硼酸鈉作穩定劑,通過過氧根以某種化學鍵的方式把二氧化氯偶合到過碳酸鈉上,由此把二氧化鈉穩定在水溶液中。該專利并聲稱:在任何情況下,二氧化氯都不會以亞氯酸鹽或亞氯酸的形式存在。顯然這一觀點忽略了過碳酸鈉在水溶液中穩定性較差這一個事實。
3.樣品的準備
樣品A: 市購滬產穩定性二氧化氯溶液,PH=9.52,ClO2含量=20493mg/L;
樣品B:市購中美合資生產的穩定性二氧化氯溶液,PH=8.73,ClO2含量=20246mg/L;
樣品C:酸化NaClO2發生ClO2氣體,用過碳酸鈉(2Na2CO3ּ3H2O2)作為穩定劑吸收ClO2制備的穩定性二氧化氯溶液,PH=9.91,ClO2含量=26262mg/L;
樣品D:酸化NaClO2發生ClO2氣體,用過硼酸鈉(NaBO3ּ4H2O)作為穩定劑吸收ClO2制備的穩定性二氧化氯溶液;PH=9.35,ClO2含量=23527mg/L;
樣品E:由我們開發的新工藝,用過碳酸鈉作穩定劑制備的穩定性二氧化氯溶液,PH=9.48,ClO2含量=33118 mg/L;
樣品F:用工業NaClO2配制而成的7%(w/w)亞氯酸鈉溶液;PH=11.5,ClO2含量=33377mgL;
樣品G:酸化NaClO2發生二氧化氯氣體,并通過NaClO2溶液進一步純化,再用蒸餾水吸收純化后的ClO2制備的純二氧化氯水溶液,裝瓶封口與冰箱冷藏,PH=6.5,ClO2濃度=400~600mg/L。
以上共六個樣品,ClO2含量用碘量法測得。
4.樣品的檢測與結果分析
4.1 紅外吸收光譜分析
用7400 型紅外分光光度計測得的6個樣品的紅外譜圖如圖4-1至圖4-6所示,圖4-7和圖4-8為所用穩定劑的紅外譜圖,而圖4-9至圖4-11為原料的標準紅外譜圖。
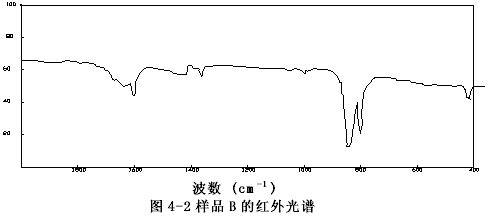
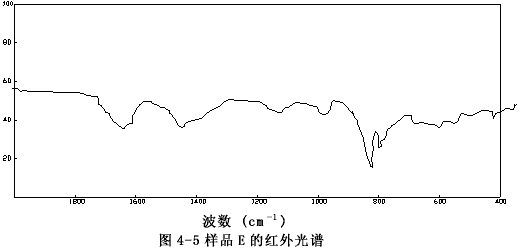
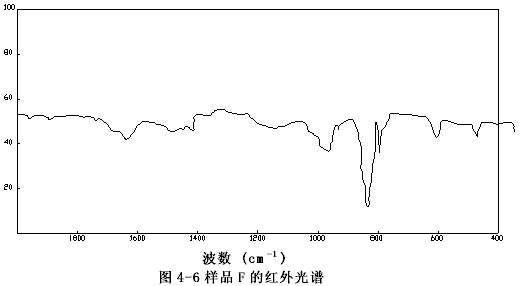
由圖4-1至圖4-6可以看出樣品A、B、C、E、F的圖譜很相似,其主要峰(800~840cm-1)重合,特別是樣品A與C,它們的圖譜幾乎完全一致,這表明市購的產品與自制的穩定性二氧化氯溶液的主要成份是一樣的。
圖4-1 樣品A的紅外譜圖
圖4-2 樣品的B紅外譜圖
圖4-3 樣品的C紅外譜圖
圖4-4 樣品的D紅外譜圖
圖4-5 樣品的E紅外譜圖
圖4-6 樣品的F紅外譜圖
圖4-7 過碳酸鈉(原料)紅外譜圖
圖4-8 過硼酸鈉(原料)紅外譜圖
圖4-9 亞氯酸鈉標準紅外譜圖
圖4-10 NaBO3ּ4H2O標準紅外譜圖
圖4-11 NaBO3ּH2O標準紅外譜圖
樣品C的譜圖(圖4-3)與過碳酸鈉的譜圖(圖4-7)相比存在極大的差異,而和樣品F亞氯酸鈉溶液的譜圖(圖4-6)十分相似,它們的主要吸收峰均在800和840cm-1處,以亞氯酸鈉的標準譜圖(圖4-9)上可以看出,這正是亞氯酸根吸收峰的位置。有所不同的是樣品F的譜圖中,在930~1000 cm-1處的吸收峰(ClO3-的特征峰之一)在樣品C的譜圖中變得很弱了,這說明樣品F中所含的氯酸根(ClO3-)在樣品C中以大大減少了。
樣品D的譜圖(圖4-4)則與樣品A、B、C、E、F的明顯不同,它的吸收峰要復雜得多,和過硼酸鈉的譜圖(圖4-8)相比主要吸收峰也發生了變化,這說明樣品D中有完全不同的一類新物質生成,文獻[3][4]認為這是一種(系列)活性配位化合物。由于硼系化合物的組成本來就很復雜,又易形成各種配位化合物及各種形式的水合物,所以吸收峰多也是符合理論的。
4.2 紙色譜法
紙色譜法是一種利用濾紙進行物質分離分析的方法,又稱為紙上層析。系用濾紙(纖維素)為固定載體,選用“異丙醇-水-吡啶-濃氨水”體系作為展開溶劑,這種溶劑可以用來分離出氯化物、亞氯酸鹽、氯酸鹽和高氯酸鹽,顯色劑則采用二苯胺。
圖4-12 紙色譜照片
圖4-13 紙色譜圖色斑描繪圖
由圖和圖可以看出,樣品G 不顯色斑,樣品C、D、E、F在初期只顯示一個斑點,放置過夜后其中樣品C、E、D的斑點發生了變化,出現了拉長的色斑,這三個樣品均含有過氧化物,溶液中過氧化物的存在導致一段時間后顯色劑氧化顯色。
樣品C 和E的色譜斑其位置、形狀與樣品F的相似,這表明它們的主要組成中均含有亞氯酸根和一定量的過氧化物。
樣品D的色譜斑與其它樣品的則存在著明顯的差異,斑點拉長也表明含有一定量的過氧化物,由于硼的過氧化物較過碳酸鈉穩定,在溶液中保存期也更長一些,所以色斑拉長更為明顯。
4.3 酪氨酸顯色反應
二氧化氯能與酪氨酸發生顯色反應生成多巴醌類顯色化合物,當溶液中含有次氯酸根(ClO-)和亞氯酸根離子(ClO2-)時,能靈敏地測出ClO2的含量[6]。6個樣品測定結果顯示只有純水溶液(樣品G)和酪氨酸試劑發生顯色反應,其它樣品則只有酸化產生游離ClO2后才發生顯色反應,這表明這些樣品中不存在以分子態形式存在的ClO2分子,它們只能以離子或化合物的形式存在。
4.4 抗酸緩沖能力測定
用6mol/L的鹽酸(HCl)溶液滴加到50ml樣品中,測定pH值的變化,得到樣品的PV-V(HCl)圖,如圖4-14所示。
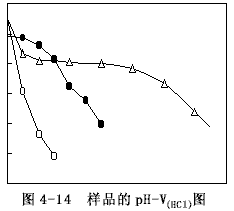
樣品C在加酸過程中有氣泡產生,這是緩沖體系受到破壞產生CO2之故,而樣品D及F無氣泡產生。由圖4-14可以看出,樣品F隨鹽酸溶液加入量的增加,pH呈直線下降,對酸沒有緩沖能力。樣品C則在pH=6~8之間有一明顯的平臺,表現了很強的緩沖能力,表明用過碳酸鈉作穩定劑的穩定液中具有多元酸的酸式鹽(NaHCO3)與次級鹽(NaHCO3)組成的緩沖體系,這與前述的理論分析是一致的。樣品D的緩沖能力介于樣品F與C之間,這表明過硼酸鈉作穩定劑的穩定液中也存在由弱酸(H3BO3)及其對應的鹽(Na2B4O7)組成的緩沖體系。
5.結 論
通過以上的實驗與測定及其它文獻[2][3][4]的報道,可以證明我們最初的理論分析是正確的,并由此得到以下幾個結論:
(1)在以過碳酸鈉(或碳酸鈉-過氧化氫)為穩定劑的穩定性二氧化氯溶液中,二氧化氯以亞氯酸根的形式存在,并處在一個由NaHCO3-Na2CO3組成的緩沖體系中,其加酸活化過程實質上是一個酸化反應過程;進一步的測試結果也表明[7],其酸化時反應的計量關系符合式(2-1)。
(2)在以過硼酸鈉為穩定劑的穩定性二氧化氯溶液中,二氧化氯可能以某種極性較弱(弱配位鍵)的活性配位化合物形式存在,并處在一個由H3BO3-Na2B4O7組成的緩沖體系中。加酸酸化時配位體同氫離子結合成弱酸,破壞了配合平衡導致活性配位物解體,從而釋放出ClO2來,因此可以認為這才是一個真正的“活化”過程。
參考文獻
1) 謝惠芳,賀啟環。非水溶液法制備穩定性二氧化氯新工藝[J]。工業水處理,1997,14(3):14,42。
2) 梁增輝,揚宗芬,王福玉等。值對穩定型二氧化氯消毒劑活化影響的研究[J]。中國消毒學雜志,1990,7(1):1~5。
3) Moises L. de Guevara, etal. AQUEOUS CHLORINE DIOXIDE ANTISEPTIC COMPOSITIONS AND PRODUCTION THEREOF [P]. U. S. P:2,701,781,1955.
4) Thomas P. Mcnicholas, etal. STABLE CHLORINE CIOXIDE COMPOSITION AND METHOD OF MADING SAME [P]. U. S. P: 3,271,242,1966.
5) Thomas P. Mcnicholas, etal. PROCESS FOR STABILIZING CHLORINE PLOXIDE SOLUTION. U. S.P: 3,278,447,1966
6) 揚宗芬,梁增輝,王富玉等。比色法測定二氧化氯含量[J]。消毒與滅菌,1989,6(4):196~198。
7) 徐瑞群,賀啟環。碩士學位論文:二氧化氯分析方法研究與二氧化氯消毒制劑測試[D]。南京:南京理工大學,2000。
[中圖分類號] TQ124、4+3
附 圖:






作者簡介:賀啟環,1943~,南京理工大學環境科學與工程系主任、副教授,發表論文40余篇。電話:025-4435333。
論文搜索
發表時間 至
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








