臭氧濕式氧化氨氮的降解過程研究
| 論文類型 | 技術(shù)與工程 | 發(fā)表日期 | 2000-01-01 |
| 來源 | 《中國(guó)給水排水》2000年第1期 | ||
| 作者 | 鐘理,KuoC.H. | ||
| 關(guān)鍵詞 | 臭氧 氧化 降解 氨氮 | ||
| 摘要 | 鐘理1,Kuo C. H.2? (1.華南理工大學(xué) 化學(xué)工程學(xué)院, 廣東 廣州 510641;2.Depart. of Chem. Eng.,Missis sippi State Univ.,MS 39762,USA) 摘要: 采用O3濕式氧化降解含氨氮的廢水,研究了不同pH、溫度、初始氨濃度對(duì)反應(yīng)過程的影響,探討了在高pH時(shí)O3的自分解催化產(chǎn)生自由 ... | ||
鐘理1,Kuo C. H.2?
(1.華南理工大學(xué) 化學(xué)工程學(xué)院, 廣東 廣州 510641;2.Depart. of Chem. Eng.,Missis sippi State Univ.,MS 39762,USA)
摘要: 采用O3濕式氧化降解含氨氮的廢水,研究了不同pH、溫度、初始氨濃度對(duì)反應(yīng)過程的影響,探討了在高pH時(shí)O3的自分解催化產(chǎn)生自由基·OH機(jī)理 和污染物的氧化降解過程。通過試驗(yàn),獲得了O3氧化氨氮過程的動(dòng)力學(xué)方程。?
關(guān)鍵詞: 臭氧; 氧化;降解;氨氮
中圖分類號(hào): X703
文獻(xiàn)標(biāo)識(shí)碼: A
文章編號(hào):1000-4602(2000)01-0014-04
Investigation on Wet-Ozonization Degradation of Ammonia Nitrogen
ZHONG Li 1, Kuo C. H.2?
(1.School of Chem. Eng., South China Univ. of Technology, Guangzhou 51064 1, C hina; ?2.Depart. of Chem. Eng., Mississippi State Univ., MS 39762, USA)
Abstract:The effect of pH value, temperature and initial ammonia concentrat ion on reaction process was studied by using wet?ozonization process for degrading NH3-N wastewater. The mechanisms for catalytic generation of hydroxyl radic al s by ozone decomposition at high pH values, and the oxidative destruction of polutants were explored. The kinetis equation of ozonizing NH3-N process was obtained based on the experiment. ?
Keywords: ozone; oxidation; degradation; ammonia nitrogen
目前含氨氮廢水的處理技術(shù)有[1、2]:合成硝化法、離子交換法、空氣蒸氣氣提法、液膜法、氯化或吸附法以及濕式催化氧化法等。其中O3在堿性條件下的濕式催化氧化過程是一種處理含氨氮廢水比較有效的技術(shù),它可以作為既含有機(jī)物又含無機(jī)污染物廢水的預(yù)處理,也可以作為廢水的深度后處理以進(jìn)一步降解廢水中的污染物。
1 試驗(yàn)部分
1.1 試驗(yàn)裝置
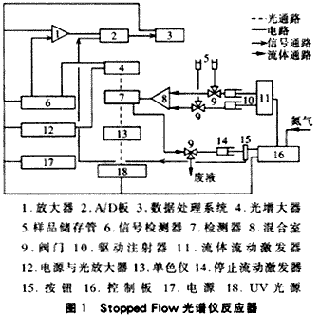
主要裝置是Hi-Tech Model SF-51型Stopped Flow光譜儀反應(yīng)器(圖1),英國(guó)制。該儀器可以在線連續(xù)準(zhǔn)確測(cè)定反應(yīng)組分對(duì)光的吸收率與時(shí)間的關(guān)系,時(shí)間的選擇范圍在0.001~7500s,即可準(zhǔn)確測(cè)定千分之一秒內(nèi)的反應(yīng)速率,尤其適用于快速反應(yīng)過程測(cè)量。L-50型臭氧發(fā)生器產(chǎn)生臭氧,臭氧濃度由碘滴定法測(cè)定,含氨氮廢水用NH4Cl自配,溶液的氨氮濃度用氨電極測(cè)定。?
首先作出O3和氨對(duì)紫外光(UV)的吸收曲線,結(jié)果表明在260nm波長(zhǎng)時(shí),O3的吸收率比氨高約6~9倍。在氨氮的氧化過程中,O3作為有限反應(yīng)物,氨相對(duì)過量,因此可通過測(cè)定有限反應(yīng)物對(duì)光的吸收率隨時(shí)間的變化關(guān)系得到氨氮降解過程的動(dòng)力學(xué)常數(shù)。
1.2 試驗(yàn)原理
氨氮的O3濕式氧化總反應(yīng)可由以下方程表示:
aO3+NH![]() QS(含NO3-或NO2-的產(chǎn)物) (1)
QS(含NO3-或NO2-的產(chǎn)物) (1)
基于上述反應(yīng)的臭氧或氨衰減動(dòng)力學(xué)方程為:
γ=[-dCo3/dt]/a=-dCNH3/dt=kCo3mCNH3n (2)
設(shè)氧化反應(yīng)遵守Arrhenius定律,則速率常數(shù)與溫度的關(guān)系為:
k=k0exp[-E/(RT)] ?(3)
試驗(yàn)中保持氨大量過量,或者反應(yīng)過程中CO3濃度較小時(shí),式(2)可以近似為:
γ=[-dCo3/dt]/a=-dCNH3/dt=k′Co3m (4)
k′=kCNH3n (5)
氧化降解過程動(dòng)力學(xué)常數(shù)的確定通常有微分法和積分法等,本文采用積分法。在恒定的溫度、氨濃度時(shí),根據(jù)式(4)對(duì)試驗(yàn)數(shù)據(jù)回歸分析,可確定相對(duì)于O3濃度的反應(yīng)級(jí)數(shù)m、表觀速率常數(shù)k′。改變氨濃度,由式(5)可確定相對(duì)于氨濃度的反應(yīng)級(jí)數(shù)n、速率常數(shù)k。改變溫度,重復(fù)上述步驟,由式(3)可獲得活化能E和指前因子k0。?
2 結(jié)果與討論
2.1 計(jì)量比的確定
在決定氨氮氧化反應(yīng)計(jì)量比a時(shí),將已知濃度O3水溶液與適量的氨氮(實(shí)際上是含NH4Cl與NH3)溶液混合,使其中一種反應(yīng)物完全消耗掉,溶液中初、終O3濃度用碘滴定法測(cè)定,氨的濃度根據(jù)下面的平衡關(guān)系,用氨電極測(cè)定。?
 (6)
(6)
在不同pH時(shí)反應(yīng)過程消耗的氨摩爾分?jǐn)?shù)XNH3對(duì)初始C0,O3/C0,NH3摩爾比關(guān)系繪于圖2。由圖2可見,計(jì)量比a在5~6之間。

2.2 氨氮的O3濕式氧化反應(yīng)
試驗(yàn)是在溫度為283~313K和pH=7~10條件下進(jìn)行,初始O3濃度為0.0002mol/ L,氨的初始濃度為0.0006~0.002mol/L。圖3給出溫度為298K和不同pH時(shí)無量綱O3濃度與時(shí)間在半對(duì)數(shù)坐標(biāo)上關(guān)系為一直線,表明氧化過程相對(duì)于臭氧濃度為一級(jí)(m=1)

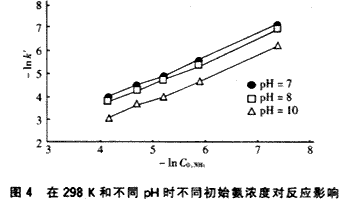
在對(duì)數(shù)坐標(biāo)上作出表觀速率常數(shù)k′與初始C0,NH3關(guān)系如圖4,直線斜率為1,表明反應(yīng)相對(duì)于氨濃度為一級(jí)(n=1),回歸分析可得溫度為298K、pH=7、8、9、10時(shí)氨的臭氧化反應(yīng)速率常數(shù)k分別為5.8 12.3、16.7和27.8。?
在pH=9及不同溫度下的k對(duì)1/T?在半對(duì)數(shù)坐標(biāo)上作圖是一直線,由直線的斜率和截距可得活化能E為3.74×104,指前因子k0為5.91×107,試驗(yàn)結(jié)果列于表1。
2.3 臭氧濕式氧化氨氮的降解過程探討
由上述結(jié)果可見,氨氮的氧化反應(yīng)計(jì)量比在5~6之間,即每破壞1 mol氨所需的O3約為5~6mol,且隨著pH增加而減少。雖然pH增加,O3的自分解速率加快,但O3自分解與O3氧化NH3的競(jìng)爭(zhēng)結(jié)果是O3對(duì)氨的氧化比O3的自分解速率快,從而使計(jì)量比下降。這表明在高pH時(shí)增加的O3與NH3的反應(yīng)足以補(bǔ)償自分解消耗的O3,能更有效地利用O3。?
由圖3、4及表1的結(jié)果顯示,O3對(duì)NH3的氧化降解隨著溶液的pH增大而加快,這是因?yàn)閜H高會(huì)加快O3的分解,誘發(fā)產(chǎn)生一種氧化能力更強(qiáng)的·OH自由基,NH3的降解既存在直接的O3分子氧化,還存在·OH自由基氧化反應(yīng)。在pH低時(shí),以直接臭氧氧化控制為主,在pH高時(shí),以自由基氧化控制機(jī)制為主,且·OH自由基氧化速率更快[3],可能的反應(yīng)機(jī)理為[4]:
O3+OH→HO2-+O2
O3+HO2-→·OH+O2-+O2 (8)
O3+NH3![]() Qs(pH值低時(shí),O3直接氧化為主) (9)?
Qs(pH值低時(shí),O3直接氧化為主) (9)?
·OH+NH3![]() Qs(pH值高時(shí),·OH自由基氧化為主) (10)?
Qs(pH值高時(shí),·OH自由基氧化為主) (10)?
此外,廢水是用NH4Cl藥劑配制,溶液中既存在NH3分子(游離氨),也存在著NH4+(氨離子),O3和·OH自由基可氧化游離NH3分子,不能氧化NH4+,根據(jù)平衡關(guān)系式(6),pH增加,平衡向右移動(dòng),溶液中的游離NH3分子增加,有利于反應(yīng)進(jìn)行。因此,氨氮的O3濕式氧化降解應(yīng)在堿性(pH=9~10)條件下進(jìn)行。?
本試驗(yàn)用NH4Cl作為試驗(yàn)藥劑,從熱力學(xué)的角度,Cl-可被O3或·OH氧化為Cl2,Cl2可以氧化NH3,為了證明NH3究竟主要被O3、·OH自由基氧化還是被Cl2氧化,試驗(yàn)還用了(NH4)2SO4代替NH4Cl進(jìn)行對(duì)比,所得的結(jié)果與用藥劑NH4Cl的相似,說明Cl2對(duì)NH3--O3的系統(tǒng)沒有影響,NH3主要被O3或·OH所氧化。試驗(yàn)還測(cè)定了最終的產(chǎn)物組成,用磺胺酸-萘胺鹽酸鹽分析結(jié)果表明,廢水中的氨氮最終氧化產(chǎn)物主要是NO3-而不是NO2-。
3 結(jié)論
廢水中的氨氮可以有效地被O3氧化降解(在本試驗(yàn)范圍,反應(yīng)計(jì)量比為5~6),且與溶液的pH有關(guān),pH提高可降低計(jì)量比,提高O3的利用率。此外,pH增大可加快氨的被氧化速率。在pH低時(shí),氧化機(jī)理主要是O3分子直接氧化機(jī)制;當(dāng)pH增加,誘發(fā)產(chǎn)生一種氧化能力很強(qiáng)的·OH自由基,氧化機(jī)理主要是自由基氧化機(jī)制,氧化速率顯著加快,故氨氮的臭氧濕式氧化降解應(yīng)在堿性條件(pH=9~10)下進(jìn)行。通過對(duì)試驗(yàn)結(jié)果回歸分析,得到pH=9時(shí)氨氮經(jīng)臭氧濕式氧化降解的動(dòng)力學(xué)方程:
γ=[-dCo3/dt]/a=-dCNH3/dt=kCo3mCNH3n
a=5.5
k=5.91×107exp[-3.74×104/(RT)]
參考文獻(xiàn):
[1] Harrison C C etal. The UV-enhanced decomposition of aqueous a mmonium nitrite[J]. J Photochem Photobiol,1995,89(3):215.
[2] Magara Y,Itoh M. The effect of operational factors on solid/liqui dseparation by ultra-membrane filtration in a biological denitrification system for colledcted human excreta treatment plants[J], Water Sci Tech, 1991,23:158 3.
[3] 鐘理,Kuo C H.叔丁醇的復(fù)合氧化反應(yīng)動(dòng)力學(xué)及其降解的研究[J].高校化 學(xué)工程學(xué)報(bào),1999,13 (3):229.
[4] 鐘理,Kuo C H.臭氧與過氧化氫的反應(yīng)動(dòng)力學(xué)及機(jī)理[J].華南理工大學(xué)學(xué) 報(bào),1997,25(12):50.
基金項(xiàng)目: 廣東省自然科學(xué)基金資助課題 (990642)
作者簡(jiǎn)介: 鐘理(1956- ),男,湖北人,華南理工大學(xué)化工學(xué)院教授,博士,研究方向:環(huán)境工程,化學(xué)工程。
電話: (020)87111517?
E-mail celzhong@scut.edu.cn
論文搜索
月熱點(diǎn)論文
論文投稿
很多時(shí)候您的文章總是無緣變成鉛字。研究做到關(guān)鍵時(shí),試驗(yàn)有了起色時(shí),是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時(shí),請(qǐng)以附件形式發(fā)至 paper@h2o-china.com ,請(qǐng)注明論文投稿。一旦采用,我們會(huì)為您增加100枚金幣。








