用表面絡合理論解釋水溶液中離子交換行為
| 論文類型 | 技術與工程 | 發表日期 | 1999-01-01 |
| 來源 | 《中國給水排水》1999年第1期 | ||
| 作者 | 趙璇,吳天寶,云桂春 | ||
| 摘要 | 趙 璇 吳天寶 云桂春 (清華大學核能技術設計研究院) 離子交換在水處理中應用十分普遍,其理論也已經逐步走向成熟。近年來,隨著工程踐的深入,對離子交換理論提出了一些新見解。 1、傳統意義上的離子交換理論 在傳統的離子交換反應中,最簡單明了的平衡理論是唐南(D ... | ||
趙 璇 吳天寶 云桂春
(清華大學核能技術設計研究院)
離子交換在水處理中應用十分普遍,其理論也已經逐步走向成熟。近年來,隨著工程踐的深入,對離子交換理論提出了一些新見解。
1、傳統意義上的離子交換理論
在傳統的離子交換反應中,最簡單明了的平衡理論是唐南(Donnan)膜平衡理論[1],即對于樹脂RA和溶液中的溶質AY平衡,認為陽離子A在樹脂中濃度比在溶液中大得多,起初A從樹脂相進入溶液相,Y從溶液相進入樹脂相,致使溶液相帶正電荷,樹脂相帶負電荷,從而在兩相間形成電位差,即唐南電勢,它可以表示為活度、溶脹壓力和摩爾濃度對體積的偏微分函數。當濃度差所產生的作用與唐南勢的作用相抵消時,即達到平衡。在離子交換中,對A、B兩種離子,當體系達到平衡時,這兩種離子的唐南勢必然相等,由此建立等式得到選擇性系數表達式。溶脹壓力越大,以及兩種互相交換的外來離子的摩爾濃度對體積的偏微分之差越大,則選擇性系數越大。
此外,按照異相化學反應研究離子交換平衡,按照離子在兩相間的分配研究離子交換平衡以及蓋恩斯-托馬斯的抽象熱力學理論也是常用的交換理論。
以上幾種理論,只是從物理化學的角度闡述了離子交換的行為,并未從微觀化學反應的角度進行描述,不易理解,公式推導及結果也比較復雜,同時單純根據熱力學定律得出的結果有時并不能與工程實際相符。本文介紹用表面絡合的概念來描述離子交換行為。
2、表面絡合理論
主要適用于弱酸或弱堿性離子交換樹脂及其它一些固相萃取劑與水溶液中離子間相互作用,德國的Hoell博士認為,水溶液中的離子之所以被樹脂吸附,是因為離子與樹脂表面發生了絡合反應,為了描述離子交換平衡,對樹脂表面作了許多假設(見圖1)。認為樹脂相存在一個假想的表面,官能團整齊地排列在這個表面上;樹脂表面的官能團通過解離或吸收質子而使表面帶電,這些電荷由被吸附的水合外來離子中和,從而形成雙電層;每一種外來離子形成自己單獨的排列層,該層到表面的距離為一個受離子本身因素如離子大小、電荷制約的特征值;特征距離越小,說明該離子的優先選擇性越強;只有排列層的外來離子才有可能與樹脂中的官能團形成絡合物;官能團的電荷一部分被位于排列層的外來離子中和,一部分被位于擴散層中的外來離子中和;樹脂表面與排列層形成具有一定容量的電容,層與層之間無排斥現象;每一個排列層都擁有與樹脂表面相同的表面積并與其平行;電位梯度與表面垂直,由表面逐漸降低,直到排列層達到一個固定值,然后向擴散層進一步降低,直至溶液。
根據Boltzman關系,排列層中A+與溶液中A+濃度存在以下關系:
C(A)st=C(A)L·exp(-Z(A)·F·Ψst/RT) (1)
式中 C(A)——濃度
Ψ——電位
Z(A)——外來離子的價態
R——氣體常數
F——法拉第常數
T——熱力學溫度
式(1)中下標st表示排列層,L表示液相(以下各式相同)。
2.1 二元平衡
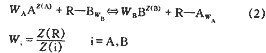
式中?R--樹脂相
A、B--外來離子
Z(i)--外來離子的價態
Z(R)--Z(A)和Z(B)的最小公倍數
假定外來離子A距表面的特征距離小于B,一部分A和B位于擴散層,模型見圖1。
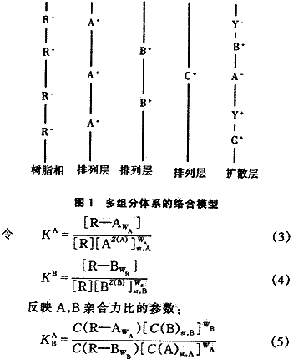
式中 C(i)--濃度
C(R-i)--排列層中形成絡合物的離子濃度
C(i)st--排列層中未形成絡合物的外來離子濃度
根據電容原理,樹脂表面電量密度σs可由表面電位Ψs和Ψst,A及由表面與第一層排列層的電容C(S,A)?
σs=C(S,A)(Ψs-Ψst,A) (6)
σst,A=C(S,A)(Ψs-Ψst,A)+C(A,B)(Ψst,A-Ψst,B) (7)
式中 C(A,B)——排列層A、B之間的電容
σst,i——i(i=A,B)排列層的電量密度
σD——擴散層的電量密度
下標s表示樹脂相表面,D表示擴散層(以下各式同)。?
由電荷平衡:
σs+σst,A+σst,B+σD=0 (8)
表面的電量密度σs為官能團與擴散層中外來離子數目的總和,A、B兩個排列層的電量分別等于層中外來離子A、B所帶電量。
σs=-FLs[Z(R)C(R-AWA)-Z(A)C(A)st,A+Z(R)C(R-BWB)-Z(B)C(B)st,B-σD]/A0S (9)
σst,A=-FLs[Z(R)C(R-AWA)-Z(A)C(A)st,A]/A0S (10)
σst,B=-FLs[Z(R)C(R-AWB)-Z(B)C(B)st,B]/A0S (11)
式中 Fls/(A0S)---把摩爾濃度轉化為電量密度
L --液體體積?
Ls--靠近樹脂表面的液體體積?
A0--比表面積?
S--樹脂質量
2.2 多組分平衡?
假設有N種外來離子被吸附,假定排列層的排列順序如下:S/A/···/I/J/···/N/D/。可以認為每種離子達到各自的局部平衡,并有著各自單獨的絡合物形成常數。N種外來離子形成N個排列層,每一層與表面之間形成電容器并擁有電容C(S,I)。另外,兩個相〖CM(22〗鄰的外來離子之間形成N-1個電容,電容值為C(I,J)。
由電中性原則可以得:
![]()
電量、電容和電壓存在以下關系:
σs=C(S,A)(Ψs-Ψst,A) (13)
σst,A=C(S,B)(Ψst,A-Ψs)+C(A,B)(Ψst,A-Ψst,B) (14)
σst,I=C(S,I)(Ψst,I-Ψst,I-1)+C(I,J)(Ψst,I-Ψst,J) (15)
σst,N=C(S,N)(ΨN-ΨN-1)+CD(ΨN-ΨD) (16)
σD=CD(ΨD-ΨN) (17)
對于每一層存在電量平衡關系:

2.3 二元體系中的分離因子
利用?Boltzman?關系可以得到兩種外來離子絡合常數的比值:

排列層中未絡合與絡合的外來離子以及擴散層中的外來離子的總和構成樹脂負荷,如果濃度用mol/L、負荷q用當量/克樹脂表示,則可以得到:?
Z(R)C(R-AWA)-Z(A)C(A)st,A-Z(A)C(A)D=q(A)S/Ls (23)
Z(R)C(R-AWB)-Z(B)C(B)st,B-Z(B)C(B)D=q(B)S/Ls (24)
由式(6)、(7)、(8)、(11)可以得出:
Ψst,A-Ψst,B=FLs[Z(B)C(B)st,B-Z(R)C(RBWB)]/A0SC(A,B) (25)
相對于排列層而言,擴散層中的電量很小,排列層中未絡合的離子又遠遠小于發生絡合的離子的量,因此這兩部分離子的量可以忽略。根據式(24)可以得出式(25)括號內為:
Z(B)C(B)st,B-Z(R)C(R-BWB)=C(B)=y(B)qmaxS/Ls (26)
式中 qmax——樹脂的總容量
y(B)——B離子在樹脂相內的當量百分比
則 ![]()
在忽略擴散層中外來離子的前提下,分離因子的對數值與外來離子的無量綱負荷呈直線關系,由此而確定的![]() 充分體現了液相總濃度和樹脂相的組成。
充分體現了液相總濃度和樹脂相的組成。
根據絡合理論,![]() 隨著y(B)增長的速度與A,B兩個排列層間的距離成比例。隨著兩個排列層間的距離增大,電容器的電容增大,直線的斜率也增加;相反,如果兩種外來離子處于同一層中,電容值為無窮大,斜率為零,此時
隨著y(B)增長的速度與A,B兩個排列層間的距離成比例。隨著兩個排列層間的距離增大,電容器的電容增大,直線的斜率也增加;相反,如果兩種外來離子處于同一層中,電容值為無窮大,斜率為零,此時![]() 為恒定值,親合力
為恒定值,親合力![]() 與斜率可以從實驗中通過作
與斜率可以從實驗中通過作![]() —y(B)的曲線獲得。
—y(B)的曲線獲得。
2.4 多組分體系中的分離因子?
假定排列層的排列順序如下:S/A/…/I/J/…/N/D/。因此存在N-1個下式:
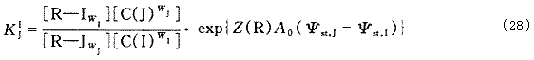 ?
?
上式的前半部分即為多組分體系中任意平衡I/J的分離因子,不考慮擴散層,則:
![]()
式中?K--從J到N的外來離子
分離因子的對數值可以由相似于二元體系中近似方法得到:
![]()
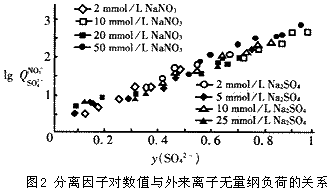
3 驗證實驗
利用陰離子交換樹脂進行實驗室規模的試驗,對以上得出的結論,即對分離因子的對數值與外來離子的無量綱負荷呈線性關系進行檢驗。結果如圖2。在實驗中,分別以硫酸根離子(樹脂為硝酸根型)與硝酸根離子(樹脂為硫酸根型)做外來離子,可以看出,分離因子的對數值lgQ與y(I)呈線性關系,并且該直線與外來離子的初始濃度無關。另外,用陽離子交換樹脂做類似實驗,也得到相同結果。
4、評述
該模型是目前國內外僅有的以絡合理論來解釋離子交換樹脂對離子吸附行為的模型,認為離子之所以被樹脂吸附,是因為處于排列層中的離子與樹脂表面發生絡合反應。與傳統理論相比較,模型本身比較簡單,直觀,易于理解。得出分離因子的對數值與外來離子的無量綱負荷呈線性關系的結果,一方面計算比較簡單,另一方面與試驗結果符合較好,能夠用來指導試驗。表面絡合理論由于其直觀的模型、簡單的結果、以及對實際較好的描述而顯示出其優越性。
但是,該模型的目的仍然是解釋離子交換行為的模型,本質上是一個交換模型,即用各種重金屬離子所處的排列層距樹脂表面的距離來表征選擇性大小,遠距離的被近距離的所取代。該模型假設太多、理想化程度較高,樹脂的內部傳質,樹脂與溶液之間傳質都未曾考慮,樹脂官能團的表面化假設也忽略了樹脂的內部傳質。因此該模型在應用于描述比較復雜的水質(例如陰離子、陽離子和有機物的體系)的離子交換行為尚有待于進一步改進和完善,一般用于弱堿性或弱酸性離子交換樹脂對離子吸附行為的描述。
此外,在最近發展起來的以表面絡合理論為基礎,利用陰離子交換樹脂去除飲用水中痕量重金屬污染的新型工藝中,該模型顯示出其巨大的優越性。
參考文獻
1、陶祖貽,趙愛民. 離子交換平衡及動力學. 西安:原子能出版社,1989.34~51?
2、Hoell W H,Franzreb M,Horst J et al. Description of ion exchange equilibria by means of the surface complexation theory. In:Marinsky J A,Marcus Y,ed. Ion Exchange and Solvent Extraction,A Series of Advances:Vol.11.Marcel Dekker,New York,NY,1993
3、Horst J,Hoell W H,Eberle S H. Application of thesurface complex formation model to exchange equilibria on ionexchange resins. Reactive Polymers,1990;13:209~231?
作者通訊處:100084 清華大學核能技術設計院?
(來稿日期 1998-09-10)
論文搜索
月熱點論文
論文投稿
很多時候您的文章總是無緣變成鉛字。研究做到關鍵時,試驗有了起色時,是不是想和同行探討一下,工作中有了心得,您是不是很想與人分享,那么不要只是默默工作了,寫下來吧!投稿時,請以附件形式發至 paper@h2o-china.com ,請注明論文投稿。一旦采用,我們會為您增加100枚金幣。








